题目内容
【题目】Ⅰ.(化学反应原理)
25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH的电离平衡常数表达式__。
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__。
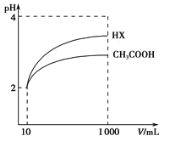
(3)体积均为l00mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数___(填“大于”、“小于”或“等于”)醋酸的电离平衡常数。
Ⅱ.(化学与生活)
防治环境污染,改善生态环境已成为全球共识。
(1)燃煤气化有助于减少PM2.5,写出焦炭与水蒸气反应的化学方程式___。
(2)采用焚烧处理垃圾进行发电已在江苏投入使用。下列是生活中的常见垃圾:
A.废纸 B.废电池 C.易拉罐 D.玻璃瓶 E.塑料制品
在焚烧处理前,除废电池外,还有___(填字母)应剔除并回收,随意丢弃电池造成的主要危害是___。
【答案】Ka=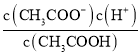 CH3COOH> H2CO3> HClO 大于 C+H2O(g)
CH3COOH> H2CO3> HClO 大于 C+H2O(g) ![]() CO+H2 CD 重金属污染
CO+H2 CD 重金属污染
【解析】
Ⅰ.(1)电离平衡常数为电离后各离子浓度幂之积与未电离的分子的浓度的比值;
(2)电离平衡常数越大,酸的电离程度越大,酸的酸性越强;
(3)酸在稀释时,酸性越强,加水稀释后pH的变化量越大;
Ⅱ.(1)焦炭与水蒸气反应生成CO和H2;
(2)在焚烧处理前,除废电池外,可剔除并回收的是易拉罐和玻璃瓶;废电池主要造成重金属污染。
Ⅰ.(1)CH3COOH的电离平衡常数表达式为Ka=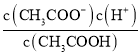 ;
;
(2)电离平衡常数越大,酸的电离程度越大,酸的酸性越强,由表格中数据可知Ka(CH3COOH)>Ka(H2CO3)>Ka(HClO) >Ka(HCO3-),因此三种酸的酸性由强到弱的顺序为;CH3COOH> H2CO3> HClO;
(3)由图象可知,酸HX稀释后pH的变化量大于CH3COOH,所以酸性HX>CH3COOH,因此HX的电离平衡常数大于醋酸的电离平衡常数。
Ⅱ.(1)焦炭与水蒸气反应生成CO和H2,反应方程式为:C+H2O(g) ![]() CO+H2;
CO+H2;
(2)在焚烧处理前,除废电池外,可剔除并回收的是易拉罐和玻璃瓶,选择CD;废电池主要造成重金属污染。

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案