题目内容
【题目】(1)已知:2N2O5(g )=2N2O4( g )+O2( g ) H1=-4.4kJ·mol-1
2NO2( g)=N2O4(g ) H2 =-55.3kJ·mol-1
则反应N2O5( g )=2NO2(g )+![]() O2(g )的H=_______ kJ·mol-1
O2(g )的H=_______ kJ·mol-1
(2)2molCH3OH(l)在O2(g)中完全燃烧,生成CO2(g)和H2O(l),放出887kJ热量:请写出CH3OH燃烧热的热化学方程式__________________________________
【答案】+53.1 CH3OH( l)+![]() O2(g )=CO2( g )+2H2O(l) H=-443.5kJ·mol-1
O2(g )=CO2( g )+2H2O(l) H=-443.5kJ·mol-1
【解析】
(1)根据盖斯定律,方程式如何叠加, 焓变就如何叠加;
(2)根据题目信息,计算焓变,写出热化学方程式即可。
(1)第一个反应编号①,第二个反应编号②,![]() 得到目标方程式,故目标反应焓变为
得到目标方程式,故目标反应焓变为![]() ,
,
故答案为:+53.1;
(2)2mol![]() 在
在![]() 中完全燃烧,生成
中完全燃烧,生成![]() 和
和![]() ,放出887kJ热量,故1mol甲醇完全燃烧放出443.5kJ热量,燃烧热为1mol可燃物完全燃烧,故热化学方程式为:CH3OH( l)+
,放出887kJ热量,故1mol甲醇完全燃烧放出443.5kJ热量,燃烧热为1mol可燃物完全燃烧,故热化学方程式为:CH3OH( l)+![]() O2(g )=CO2( g )+2H2O(l) H=-443.5kJ·mol-1 ,
O2(g )=CO2( g )+2H2O(l) H=-443.5kJ·mol-1 ,
答案为:CH3OH( l)+![]() O2(g )=CO2( g )+2H2O(l) H=-443.5kJ·mol-1。
O2(g )=CO2( g )+2H2O(l) H=-443.5kJ·mol-1。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案【题目】Ⅰ.(化学反应原理)
25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH的电离平衡常数表达式__。
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__。
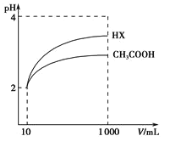
(3)体积均为l00mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数___(填“大于”、“小于”或“等于”)醋酸的电离平衡常数。
Ⅱ.(化学与生活)
防治环境污染,改善生态环境已成为全球共识。
(1)燃煤气化有助于减少PM2.5,写出焦炭与水蒸气反应的化学方程式___。
(2)采用焚烧处理垃圾进行发电已在江苏投入使用。下列是生活中的常见垃圾:
A.废纸 B.废电池 C.易拉罐 D.玻璃瓶 E.塑料制品
在焚烧处理前,除废电池外,还有___(填字母)应剔除并回收,随意丢弃电池造成的主要危害是___。





