题目内容
【题目】自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g)![]() SiF4(g)+ 2H2O(g) ΔH =-148.9kJ/mol。
SiF4(g)+ 2H2O(g) ΔH =-148.9kJ/mol。
(1)在地壳深处容易有_____气体逸出,在地壳浅处容易有_____沉积。
(2)如果上述反应的平衡常数K值变大,该反应_____(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,___。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
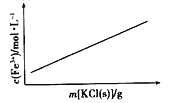
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为__________________。
【答案】SiF4和H2O SiO2 a d c 0.0010mol(L·min)
【解析】
本题考察外界条件对化学平衡的影响、化学平衡常数和化学平衡状态的的理解以及反应速率的有关计算。
(1)正反应是体积减小的可逆反应,在地壳深处压强大,有利于平衡向正反应方向进行,所以溢出的气体是SiF4和H2O;在地壳浅处,压强小,有利于平衡向逆反应方向进行,所以有二氧化硅沉积,故答案为:SiF4和H2O;SiO2;
(2)a、平衡常数K值变大说明平衡一定向正反应方向移动,故正确;
b、该反应是放热反应,平衡常数K值变大说明平衡一定向正反应方向移动,条件变化应是温度降低,降低温度,正反应速率应该是先减小,然后再逐渐减小,故错误;
c、平衡常数K值变大说明平衡一定向正反应方向移动,故错误;
d、该反应是放热反应,平衡常数K值变大说明平衡一定向正反应方向移动,条件变化应是温度降低,降低温度,逆反应速率先减小,然后再逐渐增大,故正确;
ad正确,故答案为:ad;
(3)a、由化学反应速率之比等于化学计量数之比可知,当反应达到平衡时v正(HF)= 2v逆(H2O),故错误;
b、由化学反应速率之比等于化学计量数之比可知,不管反应有没有达到平衡,均有2v(H2O)= v(SiF4),故错误;
c、SiO2的质量保持不变说明反应已经达到平衡,故正确;
d、反应达到平衡时正逆反应仍然都在进行,反应物和生成物在互相转化,只是速率相等,故d错误;
c正确,故答案为:c;
(4)容器内气体的密度增大了0.12 g/L,则气体质量增加了0.24g,以根据反应的化学方程式可知,消耗氟化氢的物质的量是0.24g÷15=0.016mol,则氟化氢的反应速率是![]() =
=![]() =0.0010mol(L·min),故答案为:0.0010mol(L·min)。
=0.0010mol(L·min),故答案为:0.0010mol(L·min)。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】Ⅰ.(化学反应原理)
25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH的电离平衡常数表达式__。
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__。
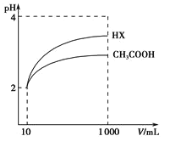
(3)体积均为l00mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数___(填“大于”、“小于”或“等于”)醋酸的电离平衡常数。
Ⅱ.(化学与生活)
防治环境污染,改善生态环境已成为全球共识。
(1)燃煤气化有助于减少PM2.5,写出焦炭与水蒸气反应的化学方程式___。
(2)采用焚烧处理垃圾进行发电已在江苏投入使用。下列是生活中的常见垃圾:
A.废纸 B.废电池 C.易拉罐 D.玻璃瓶 E.塑料制品
在焚烧处理前,除废电池外,还有___(填字母)应剔除并回收,随意丢弃电池造成的主要危害是___。