题目内容
【题目】下列说法正确的是( )
A.硼酸(H3BO3)分子中含有3个羟基,因此硼酸为三元酸
B.Ga、Ge、As、Se四种基态原子的第一电离能由小到大的顺序为Ga<Ge<Se<As
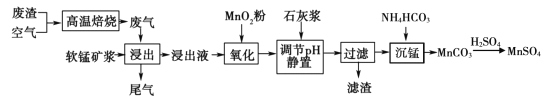
C.Cu3N形成的晶体结构如图所示,则与N3-等距离且最近的Cu+有3个

D.第二周期元素电负性由小到大顺序排列,B元素应位于第2位
【答案】B
【解析】
A.硼酸中的硼为缺电子结构,在溶液中可以结合水电离出的氢氧根形成B(OH)4-,电离方程式为H3BO3+H2O![]() B(OH)4-+H+,故硼酸为一元弱酸,A错误;
B(OH)4-+H+,故硼酸为一元弱酸,A错误;
B.一般规律:同周期元素,从左往右,第一电离能增大,As与Se相比,4p轨道半充满,更稳定,不易失电子,故As的第一电离能比Se大,即第一电离能由小到大的顺序为Ga<Ge<Se<As,B正确;
C.根据均摊法及化学式Cu3N可知,黑色小球代表Cu+,白色小球代表N3-,与N3-等距离且最近的Cu+有上、下、左、右、前、后各1个,共6个,C错误;
D.中学一般不考虑稀有气体的电负性,同周期主族元素的电负性随原子序数增大而增大,故第二周期元素(Ne元素除外)电负性:Li<Be<B<C<N<O<F,按由小到大的顺序排列,B元素排在第3位,D错误。
答案选B。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)之后才能排放。
(1)CO和H2可作为能源和化工原料,应用十分广泛。 反应CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.0 kJ·mol1
2NO(g) ΔH=+180.0 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1
2NO2(g) ΔH=116.5 kJ·mol1
回答下列问题:
①CO的燃烧热为 _________。若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_________kJ。
②写出CO将NO2还原为单质反应的热化学方程式为 ____________________
(3)汽车排气管上的催化转化器,发生上述的CO将NO2还原为单质反应。在一定温度下,将一定量的CO和NO2充入2L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________(填字母标号)。
A.2υ正(NO2)=υ逆(N2)
B. 混合气体的平均相对分子质量保持不变
C.气体总压强不再变化
D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5min,生成了0.08mol N2,则5min内υ(CO)=___molL1min1。
③25min时,物质浓度变化如图所示,则改变的条件可能是___________(填字母标号)。
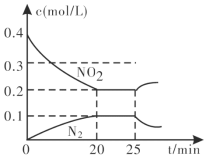
A.缩小容器体积
B.增加NO2的浓度
C.降低温度
D.升高温度
【题目】经测定乙醇的分子式是C2H6O,由于有机化合物普遍存在同分异构现象,推测乙醇分子的结构可能是下列两种之一:
Ⅰ. Ⅱ.
Ⅱ.
为确定其结构,应利用物质的特殊性质进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,甲、乙、丙三名学生利用如图所示装置进行实验确定乙醇分子的结构。图中量气装置由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~200mL),供量气用;乙管可上下移动,以调节液面高低。

(1)学生甲得到一组实验数据;
乙醇的物质的量 | 氢气的体积(标准状况下) |
0.01mol | 0.112L |
根据以上数据推断,乙醇的结构应为___(填“Ⅰ”或“Ⅱ”),原因是___。
(2)学生乙认为:为了较准确地测量氢气的体积,除了必须检查整个装置的气密性外,在读取反应前后甲管中液面读数的过程中,应注意___(填序号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平
(3)学生丙不想通过称取乙醇的质量来确定乙醇的物质的量,那么他还需要知道的数据是___。