题目内容
【题目】下列转化不能一步实现的是( )
A.Fe2O 3→Fe(OH)3 B.CuSO4→Cu
C.CaCO3→CaO D.MgSO 4→MgCl 2
【答案】A
【解析】
试题解析: A.氧化铁不溶于水,与水也不反应,;A符合题意;B.CuSO4溶液中加入金属铁,发生置换反应;能实现;C.CaCO3高温分解得到氧化钙;能实现;D.MgSO 4与氯化钡溶液反应得MgCl 2;能实现;
考点:物质之间的转化关系。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等.实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如图:
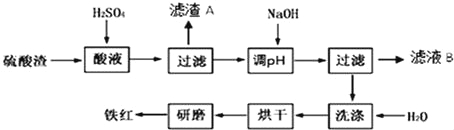
(1)硫酸渣的成分中既能与酸又能与碱反应的是 ,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: .
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是 (部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(3)滤渣A的主要成分为 ,滤液B含有的主要物质有 .
(4)如何证明洗涤环节充分洗净 .
(5)已知硫酸渣质量为a kg,假设铁红制备过程中铁元素损耗25%,最终得到铁红的质量为b kg,则原来硫酸渣中铁元素质量分数为 .(用题中所给数据计算并用最简整数比表示结果)
【题目】(1)有下列物质①Cu ②液氨 ③CH3COOH ④NaHCO3 ⑤H2O ⑥熔融NaCl ⑦NH3·H2O ⑧NH4Cl 属于弱电解质的是 (填序号)。
化学式 | NH3·H2O | HCN | CH3COOH | H2CO3 |
电离平衡常数(25℃) | Kb=1.77×10-5 | Ka=4.93×10-10 | Ka=1.76×10-9 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。上表中给出几种弱电解质的电离平衡常数,从中可以判断:在相同温度下,同浓度的三种酸溶液的导电能力由大到小的顺序为 。
(3)盐类水解程度的强弱同样与弱电解质的电离程度有一定联系,结合表中数据回答下列问题:
①25℃时,有等浓度的a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液,三种溶液的pH由大到小的顺序为 。(填溶液前序号)
②浓度相同的NaCN溶液与CH3COOK溶液相比,c(Na+)—c(CN-) c(K+)-c(CH3COO-)。(填“>”“<”或“=”)
③将等体积等物质的量浓度的盐酸和氨水混合后,溶液呈 性(填“酸”、“碱”或“中”),用离子方程式表示原因 。
④室温下,若将0.1mol·L-1盐酸滴入20ml0.1mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。b点所示溶液中的溶质是 。
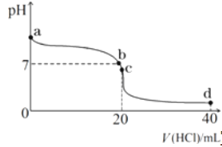
⑤NH4HCO3溶液呈 性(填“酸”、“碱”或“中”)。
(4)结合表中数据,向NaCN溶液中通入少量CO2,所发生反应的化学方程式 。