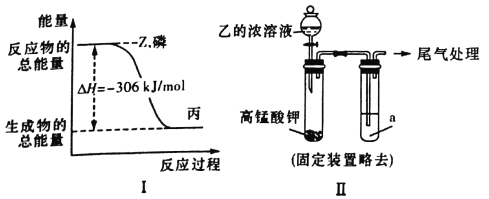
��Ŀ����
����Ŀ��NaNO2����ۺ�ʳ�����ƣ�������ζ������ʹ����ʳ�ж�����֪NaNO2�ܷ������·�Ӧ��2NaNO2��4HI=2NO����I2��2NaI��2H2O��
(1)������Ӧ����������________________��
(2)����������Ӧ������NaNO2��NaCl����ѡ�õ������У���ʳ�ס����⻯�ص�����ֽ�������ۡ����ƣ�����Ϊ����ѡ�õ�������_______________(�����)��
(3)ij����Һ�У�����2%��5%��NaNO2��ֱ���ŷŻ������Ⱦ�������Լ���ʹNaNO2ת��Ϊ�����������Ⱦ��N2����______________(��ѡ����ĸ)��
A��NaClB��NH4ClC��HNO3 D��ŨH2SO4
(4)����ƽ���»�ѧ����ʽ��Al��NaNO3��NaOH==NaAlO2��N2����H2O������Ӧ������ת��5mole���������ɱ�״����N2�����Ϊ_______L��
������(1)NaNO2��(2)�٢���(3)B��
(4)10641032��11.2��
��������
���������(1)2NaNO2+4HI�T2NO+I2+2NaI+2H2O����Ԫ�صĻ��ϼ۽���������NaNO2�����������ʴ�Ϊ��NaNO2��
(2)��ˮ�������ۡ�������NaNO2������Ӧ����������������KI��NaNO2��Ӧ����I2���������������²��ܷ�Ӧ��ʳ���������������ӣ��⻯����ʳ�ױ��������ܼ�ˮ�е���������ӣ��������Ƶ������������������ӣ�������Ӧ���ɵⵥ�ʣ�I2ʹʪ��ĵ��۵⻯����ֽ�������ʴ�Ϊ���٢���
(3)NaNO2��N2�DZ���ԭ������ӻ�ԭ����NԪ������������O��ClԪ�أ���ֻ�ܼ�NH4Cl����ԭ��������ʽΪNaNO2+NH4Cl�TNaCl+N2��+2H2O�����������е��õ�3����ָ�����еĵ����Ȼ���е�ʧȥ3����ָ�����еĵ����ʴ�Ϊ��B��
(4)AlԪ�صĻ��ϼ���0����Ϊ+3�ۣ�NԪ�صĻ��ϼ���+5�۽���Ϊ0���÷�Ӧ��Ӧ����ˮ���ɵ����غ㼰ԭ���غ��֪����ӦΪ10Al+6NaNO3+4NaOH�T10NaAlO2+3N2��+2H2O��������ת��5mole-�������ɱ�״����N2�����Ϊ5mol��![]() ��22.4L/mol=11.2L���ʴ�Ϊ��10��6��4��10��3��2��11.2��
��22.4L/mol=11.2L���ʴ�Ϊ��10��6��4��10��3��2��11.2��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ���Ի�����Ϊԭ��������������������к�Fe2O3��SiO2��Al2O3��MgO�ȣ�ʵ����ģ�ҵ���������Ʊ����죨Fe2O3����������ͼ��

��1���������ijɷ��м�������������Ӧ���� ��д�����ܹ���Fe2O3��ϡ���ᷴӦ�����ӷ�Ӧ����ʽ�� ��
��2�����������У�Ϊ��ȷ������Ĵ��ȣ�����������Ҫ������Һ��pH�ķ�Χ�� ������������������������ʽ����ʱ��Һ��pH������
������ | Fe��OH��3 | Al��OH��3 | Fe��OH��2 | Mg��OH��2 |
��ʼ���� | 2.7 | 3.8 | 7.5 | 9.4 |
��ȫ���� | 3.2 | 5.2 | 9.7 | 12.4 |
��3������A����Ҫ�ɷ�Ϊ ����ҺB���е���Ҫ������ ��
��4�����֤��ϴ�ӻ��ڳ��ϴ�� ��
��5����֪����������Ϊa kg�����������Ʊ���������Ԫ�����25%�����յõ����������Ϊb kg����ԭ������������Ԫ����������Ϊ �����������������ݼ��㲢����������ȱ�ʾ�����
����Ŀ����1�����������ʢ�Cu ��Һ�� ��CH3COOH ��NaHCO3 ��H2O ������NaCl ��NH3��H2O ��NH4Cl ����������ʵ��� ������ţ���
��ѧʽ | NH3��H2O | HCN | CH3COOH | H2CO3 |
����ƽ�ⳣ����25�棩 | Kb=1.77��10��5 | Ka=4.93��10��10 | Ka=1.76��10��9 | Ka1=4.30��10��7 Ka2=5.61��10��11 |
��2������ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ���������ϱ��и�������������ʵĵ���ƽ�ⳣ�������п����жϣ�����ͬ�¶��£�ͬŨ�ȵ���������Һ�ĵ��������ɴ�С��˳��Ϊ ��
��3������ˮ��̶ȵ�ǿ��ͬ����������ʵĵ���̶���һ����ϵ����ϱ������ݻش��������⣺
��25��ʱ���е�Ũ�ȵ�a��NaCN��Һ b��Na2CO3��Һ c��CH3COONa��Һ��������Һ��pH�ɴ�С��˳��Ϊ ��������Һǰ��ţ�
��Ũ����ͬ��NaCN��Һ��CH3COOK��Һ��ȣ�c(Na+)��c(CN��) c(K+)��c(CH3COO��)����������������������=����
��������������ʵ���Ũ�ȵ�����Ͱ�ˮ��Ϻ���Һ�� �ԣ����������������������������������ӷ���ʽ��ʾԭ�� ��
�������£�����0.1mol��L��1�������20ml0.1mol��L��1��ˮ�У���ҺpH�������������ı仯��������ͼ��ʾ��b����ʾ��Һ�е������� ��

��NH4HCO3��Һ�� �ԣ�����������������������������
��4����ϱ������ݣ���NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽ ��