题目内容
1.下列实验操作后的混合物不能用加水过滤的方法进行分离的是( )| A. | 实验室用KClO3制取氧气所剩余的KCl和MnO2的混合物 | |
| B. | 实验室用稀盐酸和大理石反应制取CO2时,得到的CaCl2和大理石的混合物 | |
| C. | 某同学用氢气还原氧化铜来制取纯净的铜,由于最后操作不当而使还原生成的铜部分被氧化后剩余的混合物 | |
| D. | 用过量的Zn粉和稀H2SO4溶液来制取H2最后剩余的混合物 |
分析 混合物不能用加水过滤的方法进行分离,则混合物均溶于水或均不溶于水,以此来解答.
解答 解:A.KCl和MnO2的混合物中,KCl溶于水,而MnO2不溶于水,可利用加水过滤分离,故A正确;
B.CaCl2和大理石的混合物中,CaCl2溶于水,而大理石不溶于水,可利用加水过滤分离,故B正确;
C.铜部分被氧化后剩余的混合物中,Cu、CuO均不溶于水,则加水过滤不能分离,故C错误;
D.剩余的混合物中,只有Zn不溶于水,可加水过滤分离,故D正确;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
11.铅蓄电池的电池反应为:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$ 2PbSO4 (s)+2H2O(l).下列说法正确的是( )
| A. | 放电时,正极的反应式是:PbO2+SO42-+4H++2e-═PbSO4+2H2O | |
| B. | 放电时,电解质溶液中的H+向负极移动 | |
| C. | 充电时,阳极的电极反应为:PbSO4+2e-═Pb(s)+SO42- | |
| D. | 充电时,当有20.7gPb生成时,转移的电子为0.1mol |
12.锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3•H2O═Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O.
请回答下列问题.
(1)上述方程式中涉及到的N、O元素电负性由小到大的顺序是N<O.
(2)基态S的价电子排布式为3s23p4.与Cu同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是,其中P原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量的KCN溶液,生成配合物[Cu(CN)4]2-,则1molCN-中含有的π键的数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm(1pm=10-10cm),列式计算晶体铜的密度9.0g/cm3.
(6)下表列出了含氧酸酸性强弱与非羟基氧原子数的关系.
由此可得出的判断含氧酸强弱的一条经验规律是含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.亚磷酸(H3PO3)也是中强酸,它的结构式为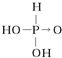 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
请回答下列问题.
(1)上述方程式中涉及到的N、O元素电负性由小到大的顺序是N<O.
(2)基态S的价电子排布式为3s23p4.与Cu同周期且最外层电子数相等的元素还有K、Cr(填元素符号).
(3)PO43-的空间构型是,其中P原子的杂化方式为sp3.
(4)在硫酸铜溶液中加入过量的KCN溶液,生成配合物[Cu(CN)4]2-,则1molCN-中含有的π键的数目为2NA.
(5)铜晶体为面心立方最密集堆积,铜的原子半径为127.8pm(1pm=10-10cm),列式计算晶体铜的密度9.0g/cm3.
(6)下表列出了含氧酸酸性强弱与非羟基氧原子数的关系.
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH | 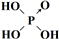 | 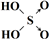 | 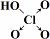 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
.亚磷酸与过量的氢氧化钠溶液反应的化学方程式为H3PO3+2NaOH=Na2HPO3+2H2O.
16.下列各种物质中,碳、氢质量比为一定值的是( )
| A. | 甲烷和乙烷 | B. | 乙烯和丙烯 | C. | 苯和乙炔 | D. | 乙炔和丙炔 |
6.已知,还原性Fe>Cu>Fe2+.将m g铁放入含有a mol FeCl3和b mol CuCl2的混合溶液中,充分反应后,固体粉末仍为m g.则a:b可能是( )
| A. | 8:7 | B. | 2:7 | C. | 1:1 | D. | 1:5 |
13.一种饱和一元醛和一种烯烃形成的混合物,经测定其中含氧的质量分数为a,则该混合物中含氢的质量分数为( )
| A. | $\frac{b(1-a)}{7}$ | B. | $\frac{1-a}{7}$ | C. | $\frac{a}{8}$ | D. | 无法确定 |
6.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 常温常压下,32gO2和32gO3所含氧原子数都是NA | |
| C. | 1molFe与足量盐酸反应,转移电子数为3NA | |
| D. | 标准状况下36g H2O中原子的数目为6NA |
 CH3COOC2H5+H2O
CH3COOC2H5+H2O