题目内容
9. 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜.当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜.当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )| A. | 溶液的质量减小程度:乙<甲 | |
| B. | 溶液的导电能力变化:甲>乙 | |
| C. | 甲中阴极和乙中镁电极上析出物质质量:甲=乙 | |
| D. | 电极反应式:甲中阳极:2Cl--2e→Cl2↑,乙中正极:Cu2++2e→Cu |
分析 甲为电解池,乙为原电池,
A、甲中总反应为:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑,乙中总反应为:Mg+Cu2+=Cu+Mg2+,据此分析;
B、甲为电解电解质的反应,溶液中离子浓度减小;
C、甲中阴极析出Cu,乙中镁电极溶解;
D、甲中阳极上氯离子放电,乙中正极上铜离子放电.
解答 解:甲为电解池,乙为原电池,甲中总反应为:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu+Cl2↑,乙中总反应为:Mg+Cu2+=Cu+Mg2+,当两装置电路中通过的电子都是1mol时,
A、甲溶液中,阳极上析出35.5g氯气,阴极上生成32gCu,通过1mol电子时,溶液质量减少67.5g,乙中溶液中负极溶解12gMg,正极析出32gCu,溶液质量减少20g,所以溶液的质量减小程度:乙<甲,故A正确;
B、甲为电解电解质的反应,溶液中离子浓度减小,乙为原电池反应,电荷浓度不变,所以溶液的导电能力变化:甲>乙,故B正确;
C、甲中阴极析出Cu,乙中镁电极溶解,所以质量不相同,故C错误;
D、甲中阳极上氯离子放电,乙中正极上铜离子放电,电极反应式为甲中阳极:2Cl--2e→Cl2↑,乙中正极:Cu2++2e→Cu,故D正确;
故选C.
点评 本题考查原电池和电解池的原理,注意离子在溶液中的放电顺序,题目难度中等.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
6.下列物质分离提纯的方法不正确的是( )

| A. | 用工业酒精制无水乙醇选择装置③ | B. | 提纯含砂石的粗苯甲酸选择装置①② | ||
| C. | 从溴水中提纯溴选择装置④ | D. | 苯中混有少量溴苯选择装置③ |
20.已知反应X(g)+Y(g)?R(g)+Q(g)的平衡常数与温度的关系如表.830℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内${\;}_{v}^{+}$(X)=0.005mol/(L•s).下列说法正确的是( )
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 4 s时容器内c(Y)=0.76 mol/L | |
| B. | 830℃达平衡时,X的转化率为80% | |
| C. | 反应达平衡后,升高温度,平衡正向移动 | |
| D. | 1200℃时反应R(g)+Q(g)?X(g)+Y(g)的平衡常数K=0.4 |
18.在0.1 mol•L-1CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1 mol•L-1 HCl溶液,溶液中c(H+)不变 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
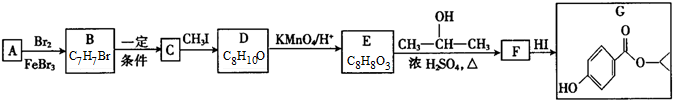
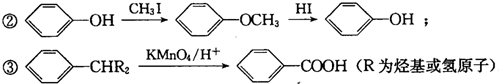
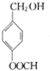
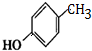 G的官能团名称为羟基和酯基
G的官能团名称为羟基和酯基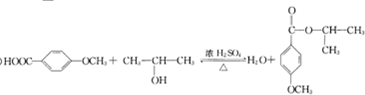

 .
.





 如图是某同学设计的放热反应的观察装置,其实验操作是:
如图是某同学设计的放热反应的观察装置,其实验操作是: