题目内容
14.下列各溶液中,Na+的物质的量浓度最大的是( )| A. | 4L 0.5mol•L-1的NaCl溶液 | B. | 1L 0.3mol•L-1的Na2SO4溶液 | ||
| C. | 0.8L 0.4mol•L-1的NaOH的溶液 | D. | 2L 0.15mol•L-1的Na3PO4的溶液 |
分析 电解质离子的浓度=电解质浓度×电解质电离出该离子的数目,与溶液的体积无关,据此结合选项判断.
解答 解:A、4L 0.5mol•L-1的NaCl溶液中Na+浓度为0.5mol/L×1=0.5mol/L;
B、1L 0.3mol/LNa2SO4溶液中Na+浓度为0.3mol/L×2=0.6mol/L;
C、0.8L 0.4mol•L-1的NaOH溶液中Na+浓度为0.4mol/L×1=0.4mol/L;
D、2L 0.15mol/LNa3PO4溶液Na+浓度为0.15mol/L×3=0.45mol/L;
故选B.
点评 本题考查物质的量浓度,比较基础,注意电解质溶液中离子的浓度与电解质浓度的计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列叙述正确的是( )
| A. | 在同温同压下,甲容器中的氧气(O2)和乙容器中的氨气(NH3)所含的原子个数相同,则甲、乙两容器中气体的体积之比为1:2 | |
| B. | 任何条件下,等物质的量的甲烷(CH4)和一氧化碳所含的原子数一定相等 | |
| C. | 在标准状况时,20ml NH3与60ml N2所含的原子个数比为1:3 | |
| D. | 同温同压下,1L一氧化碳气体一定比1L氧气的质量小 |
2.下列物质中分子数最多的是( )
| A. | 标准状况下11.2LSO2 | B. | 3.01×1023个N2分子 | ||
| C. | 0.75mol H2SO4 | D. | 9g H2O |
19.在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A. | X2为0.2mol/L | B. | Y2为0.4mol/L | ||
| C. | Z为0.3mol/L、X2为0.15mol/L | D. | Z为0.3mol/L、Y2为0.25mol/L |
3.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 2 mol•L-1 的Na2SO4溶液中含有4NA个Na+ | |
| B. | 16克甲烷所含的电子数为10NA | |
| C. | 常温常压下,11.2L氧气中所含有的原子数为NA | |
| D. | NA个水分子的相对分子质量之和等于水的摩尔质量 |
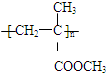 它的链节为
它的链节为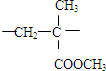 ,设其平均聚合度为3000,则该高聚物得平均相对分子质量为300 000.从结构角度看它应该属于线 型高分子.试推测有机玻璃能溶于CHCl3,具有热塑(填“热塑”或“固热”)性.
,设其平均聚合度为3000,则该高聚物得平均相对分子质量为300 000.从结构角度看它应该属于线 型高分子.试推测有机玻璃能溶于CHCl3,具有热塑(填“热塑”或“固热”)性.