题目内容
17.下列有关反应:4NH3 (g)+5O2 (g)═4NO(g)+6H2O(g)△H (298K)=-905kJ•mol-1 的描述不正确的是( )| A. | 生成物的总能量小于反应物的总能量 | |
| B. | 该反应为吸热反应 | |
| C. | 该反应为放热反应 | |
| D. | 该反应中每4 mol NH3(g)被氧化,放出905 kJ热量 |
分析 △H<0,正反应放热,反应物总能量大于生成物总能量,每有4 mol NH3(g)被氧化,放出905KJ的热量,据此解答.
解答 解:A、△H<0,正反应放热,反应物总能量大于生成物总能量,故A正确;
B、△H<0,正反应放热,故B错误;
C、△H<0,正反应放热,故C正确;
D、每有4 mol NH3(g)被氧化,放出905KJ的热量,故D正确;
故选:B.
点评 本题考查了热化学方程式的意义和表示方法,反应焓变的分析判断,题目较简单.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
7.实验室用NaCl固体配200mL 1.0mol/L NaCl溶液,下列判断不对的是( )
| A. | 用托盘天平称取NaCl固体11.7g | |
| B. | 应选用250 mL的容量瓶配制此溶液 | |
| C. | 在转移操作中不慎将溶液洒到容量瓶外面,应该重新配制溶液 | |
| D. | 加蒸馏水至离刻度线1-2 cm时改用胶头滴管定容 |
5.下列叙述正确的是( )
| A. | 在同温同压下,甲容器中的氧气(O2)和乙容器中的氨气(NH3)所含的原子个数相同,则甲、乙两容器中气体的体积之比为1:2 | |
| B. | 任何条件下,等物质的量的甲烷(CH4)和一氧化碳所含的原子数一定相等 | |
| C. | 在标准状况时,20ml NH3与60ml N2所含的原子个数比为1:3 | |
| D. | 同温同压下,1L一氧化碳气体一定比1L氧气的质量小 |
2.下列物质中分子数最多的是( )
| A. | 标准状况下11.2LSO2 | B. | 3.01×1023个N2分子 | ||
| C. | 0.75mol H2SO4 | D. | 9g H2O |
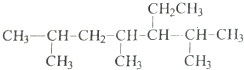 的系统命名是2,4,6-三甲基-3-乙基庚烷.
的系统命名是2,4,6-三甲基-3-乙基庚烷.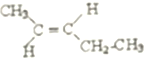 .
.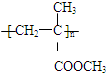 它的链节为
它的链节为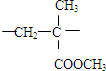 ,设其平均聚合度为3000,则该高聚物得平均相对分子质量为300 000.从结构角度看它应该属于线 型高分子.试推测有机玻璃能溶于CHCl3,具有热塑(填“热塑”或“固热”)性.
,设其平均聚合度为3000,则该高聚物得平均相对分子质量为300 000.从结构角度看它应该属于线 型高分子.试推测有机玻璃能溶于CHCl3,具有热塑(填“热塑”或“固热”)性.