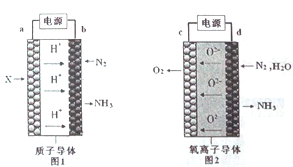
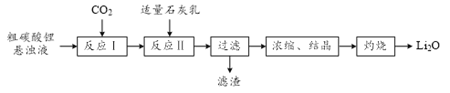
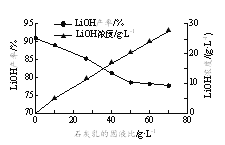
题目内容
【题目】A、B、C、D、E 五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中 A 为澄清溶液,C 为难溶的白色固体,E 则易溶于水,若取 A 溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃)。

请回答下列问题:
(1)写出化学式:A_____,B_____,C_____,D_____,E_____。
(2)写出下列反应的离子方程式: A→B:____ B→D:_____C→E:_____
【答案】KAlO2 Al(OH)3 A12O3 AlCl3 NaAlO2 AlO2-+CO2+2H2O= Al(OH)3↓+HCO3- Al(OH)3+3H+=Al3++3H2O A12O3+2OH-=2AlO2-+H2O
【解析】
B、C都既能与盐酸反应又能与NaOH溶液反应,应为两性化合物,因B加热分解可生成C,则可知B为Al(OH)3,C为A12O3,则D为AlCl3,E为NaAlO2,若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃片),说明A中含有K元素,A能与二氧化碳反应生成Al(OH)3,则A应为KAlO2,结合对应物质的性质解答该题。
(1)通过以上分析知,A、B、C、D、E分别是KAlO2、Al(OH)3、A12O3、AlCl3、NaAlO2,
故答案为:KAlO2;Al(OH)3;A12O3;AlCl3;NaAlO2;
(2)A→B的反应为AlO2-和Al(OH)3的转化,反应的离子方程式为AlO2-+CO2+2H2O= Al(OH)3↓+HCO3-,
B→D的反应为Al(OH)3和Al3+的转化,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:AlO2-+CO2+2H2O= Al(OH)3↓+HCO3-;Al(OH)3+3H+=Al3++3H2O;
(3)C→E的反应为氧化铝溶于氢氧化钠溶液,反应的离子方程式:A12O3+2OH-=2AlO2-+H2O,
故答案为:A12O3+2OH-=2AlO2-+H2O。

 名校课堂系列答案
名校课堂系列答案