题目内容
4.已知草酸晶体(H2C2O4•xH2O)的熔点为101℃,分解温度为189.5℃,升华温度为157℃,受热分解产生CO2、CO、H2O,草酸钙不溶于水.请用下列仪器对草酸晶体的分解产物进行分析: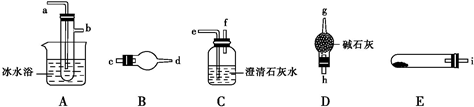
(1)写出草酸晶体受热分解的化学方程式:H2C2O4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+CO↑+(x+1)H2O
(2)按正确顺序连接好各仪器:(填仪器接口字母编号)
(i)→( )( )→( )( )→( )( )→( )( )
(3)A装置的作用是冷凝草酸蒸气,避免进入C中生成草酸钙沉淀,干扰对CO2的检验,B装置中的试剂为无水CuSO4
(4)如何验证产物中有CO生成?在g处点燃气体,并在上方罩一个内涂有澄清石灰水的小烧杯,若火焰呈淡蓝色且石灰水变浑浊,则有CO产生
(5)某学生利用上述仪器进行x值的测定,取一定量的草酸晶体充分加热,测得装置A增重4.5g,B增重4.5g,C增重2.2g,则x=4.
分析 (1)草酸晶体热分解生成二氧化碳、一氧化碳和水,结合原子守恒配平书写化学方程式;
(2)受热分解产生CO2、CO、H2O,受热在E装置中加热,生成的气体通过装置C中的硫酸铜固体检验生成的水,连接装置A冷却避免草酸蒸汽进入石灰水生成沉淀干扰二氧化碳的检验,通过连接装置C检验二氧化碳的存在,通过装置D吸收多余的二氧化碳,在g处点燃检验一氧化碳的存在;
(3)A的目的是避免草酸蒸汽进入装置C干扰二氧化碳的检验,B为检验生成的水蒸气,用无水硫酸铜;
(4)在最后点燃,在火焰上罩上内壁沾有涂有石灰水的烧杯,看是否浑浊分析判断;
(5)A增重为未反应草酸的质量,B增重是生成水的质量,装置C增重为生成二氧化碳气体的质量,
解答 解:(1)草酸晶体受热分解产生CO2、CO、H2O,反应的化学方程式为:H2C2O4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+CO↑+(x+1)H2O,
故答案为:H2C2O4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+CO↑+(x+1)H2O;
(2)受热分解产生CO2、CO、H2O,受热在E装置中加热,生成的气体通过装置C中的硫酸铜固体检验生成的水,连接装置A冷却避免草酸蒸汽进入石灰水生成沉淀干扰二氧化碳的检验,通过连接装置C检验二氧化碳的存在,通过装置D吸收多余的二氧化碳,在g处点燃检验一氧化碳的存在,装置连接顺序为:(i)→(c)(d)→(a)(b)→(e)(f)→(h)(g),
故答案为:icdabefhg;
(3)上述分析可知装置A的作用是冷凝草酸蒸气,避免进入C中生成草酸钙沉淀,干扰对CO2的检验,B装置检验生成的水蒸气,其中的试剂为无水CuSO4,
故答案为:冷凝草酸蒸气,避免进入C中生成草酸钙沉淀,干扰对CO2的检验;无水CuSO4
(4)剩余的一氧化碳气体检验方法是在g处点燃,在火焰上罩上内壁沾有涂有石灰水的烧杯,看是否浑浊,若出现浑浊证明生成一氧化碳气体,
故答案为:在g处点燃气体,并在上方罩一个内壁涂有澄清石灰水的小烧杯,若火焰呈淡蓝色且石灰水变浑浊,则有CO产生;
(5)A增重为未反应草酸的质量,B增重是生成水的质量物质的量=$\frac{4,5g}{18g/mol}$=0.25mol,装置C增重为生成二氧化碳气体的质量,物质的量=$\frac{2.2g}{44g/mol}$=0.05mol,结合化学方程式计算,
H2C2O4•xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+CO↑+(x+1)H2O
1 x+1
0.05mol 0.25mol
x=4
故答案为:4;
点评 本题考查了物质性质的实验分析,产物的实验验证方法,化学式的计算确定,注意物质的检验实验设计,掌握基础是关键,题目难度中等.

| A. | 112mL | B. | 224mL | C. | 336mL | D. | 500mL |

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 开始沉淀的pH | 1.9 | 7.0 | 4.7 |
| 完全沉淀的pH | 3.2 | a | 6.7 |
(1)化学上通常认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达到完全.已知Fe(OH)2的Ksp约为1.0×10-15,则a=9.
(2)加入氧化剂的目的是将Fe2+氧化成Fe3+,X应选择C.
A.K2Cr2O7 B.浓HNO3 C.H2O2 D.KMnO4
(3)加入的物质Y是CuO[Cu(OH)2、CuCO3、Cu2(OH)2CO3也可以].
(4)设计实验从溶液Ⅲ中获得纯净的CuCl2•2H2O.简要描述实验步骤应在HCl气流中加热蒸发结晶,过滤、冰水洗涤、低温烘干.
| A. | 乙烯的比例模型: | B. | 丙烷分子的球棍模型: | ||
| C. | 醋酸钠的分子式:CH3COONa | D. | 乙酸的结构简式:CH3COOH |
| A. | “辽宁舰”上用于舰载机降落拦阻索的是一种特种钢缆,属于新型无机非金属材料 | |
| B. | 新型氢动力计程车的投入使用有益于减少雾霾的产生 | |
| C. | 新型复合材料使手机、电脑等电子产品更轻巧、实用和新潮 | |
| D. | 生物柴油是由动植物油脂与甲醇或乙醇,在酸或碱的催化及高温下进行反应,或在温和的条件下,用酶催化反应,生成的高级脂肪酸甲酯或乙酯 |
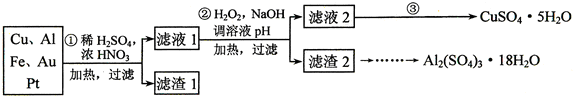
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O $\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(2)第②步中加入H2O2的作用是将Fe2+氧化为Fe3+,使用H2O2的优点是过氧化氢做氧化剂不引入杂质,对环境无污染;调溶液pH的目的是使Fe3+、Al3+沉淀除去.
(3)简述第③步由滤液2得到CuSO4•5H2O的方法是加热滤液2,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体
(4)由滤渣2制取Al2(SO4)3•18H2O,设计了以下三种方案:
甲:滤渣2$\stackrel{H_{2}SO_{4}}{→}$酸浸液$→_{蒸发、冷却、结晶、过滤}^{\;}$Al2(SO4)3•18H2O
乙:滤渣2$\stackrel{H_{2}SO_{4}}{→}$酸浸液$→_{过滤}^{适量AI粉}$滤液$→_{蒸发、冷却、结晶、过滤}^{.}$Al2(SO4)3•18H2O
丙:滤渣2$→_{过滤}^{NaOH溶液}$滤液$\stackrel{H_{2}SO_{4}}{→}$溶液$→_{蒸发、冷却、结晶、过滤}^{\;}$Al2(SO4)3•18H2O
上述三种方案中,甲方案不可行,原因是所得产品中含有较多Fe2(SO4)3杂质;从原子利用率角度考虑,乙方案更合理.
(5)用滴定法测定CuSO4•5H2O含量.取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c
mol•L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL.滴定反应如下:Cu2++H2Y2-→CuY2-+
2H+.写出计算CuSO4•5H2O质量分数的表达式ω=$\frac{c×b×1{0}^{-3}×250×5}{a}$×100%.
| A. | 0.1g | B. | >0.1g | C. | <0.1g | D. | 无法确定 |
