题目内容
【题目】已知某反应的平衡常数表达式为:K=![]() 其平衡常数随温度变化如下表所示:请回答下列问题:
其平衡常数随温度变化如下表所示:请回答下列问题:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | K1 |
(1)该反应的ΔH______0(填“>”或“<”)。
(2)若在500 ℃时进行上述反应,某时刻测得四种物质的体积分数彼此相等,则此时反应_____向进行中(“正”或“逆”);
(3)850 ℃时在一个固定体(反应器中,投入2 molCO和3 molH2O(g),发生上述反应,CO和H2O(g)的浓度变化如图所示,则

①4 min时H2的物质的量分数=___________;②K1=_____________;
③若4分钟时测得反应的热效应数值为a kJ,则该反应的热化学方程式为:_________;
④若第6分钟将容器压缩为5L,画出6~8分钟CO的浓度变化图像(注明起点坐标)______________;
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度随时间变化如下表。

①3~4min时,v正________v逆(填“>”或“=”或“<”),C1 ____0.08 mol/L(填“>”或“=”或“<”);
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是_________ (单选),反应在5 min~6 min,平衡向正方向移动,可能的原因是___________ (单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
【答案】 < 正 24% K1= 1 CO(g) + H2O(g) = CO2(g) + H2(g) ΔH =![]() kJ/mol
kJ/mol  = > D 【答题空10】A
= > D 【答题空10】A
【解析】试题分析:根据平衡常数表达式,可知反应方程式是CO(g) + H2O(g) ![]() CO2(g) + H2(g);(1)温度升高K减小,可知升高温度平衡逆向移动;(2)根据Q与K的关系分析反应方向;(3)利用“三段式”计算①4 min时H2的物质的量分数、② K1;
CO2(g) + H2(g);(1)温度升高K减小,可知升高温度平衡逆向移动;(2)根据Q与K的关系分析反应方向;(3)利用“三段式”计算①4 min时H2的物质的量分数、② K1;
③ 投入3 molH2O(g),开始的浓度是0.3mol/L,所以容器的体积是10L, 4分钟时消耗水蒸气1.2mol,测得反应的热效应数值为a kJ,则消耗1mol水蒸气放热![]() ;
;
④若第6分钟将容器压缩为5L,CO的浓度变为0.16 mol/L,加压后平衡不移动,所以8分钟时CO的浓度还是0.16 mol/L;
(4)①3~4min时,CO浓度不变,反应达到平衡;温度升高平衡逆向移动,所以平衡时CO浓度增大;
②根据影响化学平衡移动的因素分析;
解析:根据平衡常数表达式,可知反应方程式是CO(g) + H2O(g) ![]() CO2(g) + H2(g);(1)温度升高K减小,升高温度平衡逆向移动,所以该反应的ΔH<0;(2)若在500 ℃时进行上述反应,某时刻测得四种物质的体积分数彼此相等,则此Q=1,500 ℃时反应的平衡常数K=9,K>Q,所以平衡正向进行中;
CO2(g) + H2(g);(1)温度升高K减小,升高温度平衡逆向移动,所以该反应的ΔH<0;(2)若在500 ℃时进行上述反应,某时刻测得四种物质的体积分数彼此相等,则此Q=1,500 ℃时反应的平衡常数K=9,K>Q,所以平衡正向进行中;
(3)
CO(g) + H2O(g) = CO2(g) + H2(g)
起始 0.2 0.3 0 0
转化 0.12 0.12 0.12 0.12
平衡 0.08 0.18 0.12 0.12
①4 min时H2的物质的量分数![]() 、② K1=
、② K1=![]() ;
;
③ 投入3 molH2O(g),开始的浓度是0.3mol/L,所以容器的体积是10L, 4分钟时消耗水蒸气1.2mol,测得反应的热效应数值为a kJ,则消耗1mol水蒸气放热![]() ,所以该反应的热化学方程式为CO(g) + H2O(g) = CO2(g) + H2(g) ΔH =
,所以该反应的热化学方程式为CO(g) + H2O(g) = CO2(g) + H2(g) ΔH =![]() kJ/mol;
kJ/mol;
④若第6分钟将容器压缩为5L,CO的浓度变为0.16 mol/L,加压后平衡不移动,所以8分钟时CO的浓度还是0.16 mol/L,图像是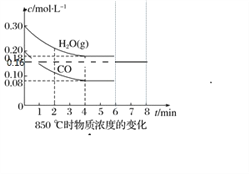 ;
;
(4)①3~4min时,CO浓度不变,反应达到平衡,V(正)= V(逆);温度升高平衡逆向移动,所以平衡时CO浓度增大,C1 >0.08 mol/L;
②增大反应物浓度平衡正向移动,所以增加水蒸气平衡正向移动,水蒸气浓度增大、CO浓度减小;正反应放热,降低温度 平衡正向移动,水蒸气浓度、CO浓度都减小;使用催化剂平衡不移动;增大生成物浓度平衡逆向移动,所以增加氢气浓度平衡逆向移动,反应在4 min~5 min,平衡向逆方向移动,可能的原因是D,反应在5 min~6 min,平衡向正方向移动,可能的原因是A;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案