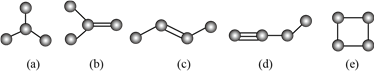
题目内容
【题目】(1)将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)![]() N2O4(g) ΔH1
N2O4(g) ΔH1
2NO2(g)![]() N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母) 。

②N2O4与O2、H2O化合的化学方程式是 。
(2)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1 mol N2,其ΔH=
kJ·mol1。

(3)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O | C | H—O | C—H |
E/(kJ·mol1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1= kJ·mol1;已知ΔH2=58 kJ·mol1,则ΔH3= kJ·mol1。
【答案】(12分)
(1)①A(2分) ②2N2O4+O2+2H2O![]() 4HNO3(3分)
4HNO3(3分)
(2)139(2分)
(3)99(2分) +41(3分)
【解析】(1)①物质由气态转为液态时,应放出热量,所以N2O4(g)的能量高于N2O4(l)的能量,只有A选项正确。②N2O4与氧气、水反应,由得失电子守恒可知N2O4中N的化合价升高,只能变为+5价,生成硝酸。
(2)根据图像可知反应热为:209 kJ·mol1348 kJ·mol1=139 kJ·mol1。
(3)由反应热与键能的关系可得,ΔH1=1 076 kJ·mol1+2×436 kJ·mol13×413 kJ·mol1343 kJ·mol1465 kJ·mol1=99 kJ·mol1;依据盖斯定律知,反应③=②①,则ΔH3=ΔH2ΔH1=58 kJ·mol1(99 kJ·mol1)=+41 kJ·mol1。

【题目】已知某反应的平衡常数表达式为:K=![]() 其平衡常数随温度变化如下表所示:请回答下列问题:
其平衡常数随温度变化如下表所示:请回答下列问题:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | K1 |
(1)该反应的ΔH______0(填“>”或“<”)。
(2)若在500 ℃时进行上述反应,某时刻测得四种物质的体积分数彼此相等,则此时反应_____向进行中(“正”或“逆”);
(3)850 ℃时在一个固定体(反应器中,投入2 molCO和3 molH2O(g),发生上述反应,CO和H2O(g)的浓度变化如图所示,则

①4 min时H2的物质的量分数=___________;②K1=_____________;
③若4分钟时测得反应的热效应数值为a kJ,则该反应的热化学方程式为:_________;
④若第6分钟将容器压缩为5L,画出6~8分钟CO的浓度变化图像(注明起点坐标)______________;
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度随时间变化如下表。

①3~4min时,v正________v逆(填“>”或“=”或“<”),C1 ____0.08 mol/L(填“>”或“=”或“<”);
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是_________ (单选),反应在5 min~6 min,平衡向正方向移动,可能的原因是___________ (单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度