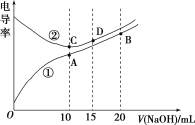
题目内容
【题目】下表为元素周期表的一部分,表中所列的字母分别代表一种化学元素。
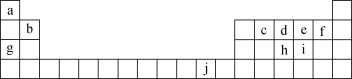
回答下列问题:
(1)写出元素f的基态原子核外电子排布式:____。
(2)写出元素h的基态原子核外电子轨道表示式:________。
(3)基态b原子电子占据最高能级的电子云轮廓图为_________
(4)ce2分子的电子式为____。
(5)d、g、h的原子半径由小到大的顺序是_______(用元素符号表示)
(6)用一个化学方程式证明e、i的非金属性的强弱_________。
(7)d的简单氢化物比h的简单氢化物沸点____(填“高”或“低”),请分析其原因____,写出j的原子结构示意图_____________
【答案】1s22s22p5 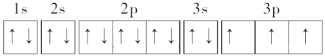 球形 CO2 N<P<Na 2H2S+O2
球形 CO2 N<P<Na 2H2S+O2![]() 2H2O+S 高 NH3分子间可以形成氢键,而PH3分子间不能形成氢键
2H2O+S 高 NH3分子间可以形成氢键,而PH3分子间不能形成氢键 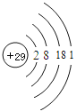
【解析】
根据元素在周期表中的位置可知,a为H、b为Be、c为C、d为N、e为O、f为F、g为Na、h为P、i为S、j为Cu。根据元素的原子序数,写出其核外电子排布式、以及原子示意图,根据元素在周期表中的变化规律,进行原子半径大小比较,以及非金属性强弱的判断。
(1)元素f为F元素,F元素的原子序数为9,其基态原子核外电子排布式1s22s22p5;
(2)元素h为P元素,P元素的原子序数为15,其基态原子核外电子排布式为1s22s22p63s23p3,故基态P原子核外电子轨道表示式为 ;
;
(3)元素b为Be元素,其原子序数为4,核外电子排布式为1s22s2,故基态Be原子电子占据最高能级2s能级,2s能级的电子云轮廓图为球形;
(4)元素c为C元素、元素e为O元素,故ce2分子的电子式为CO2;
(5)元素d为N元素、元素g为Na元素、元素h为P元素,同周期主族元素的原子半径随着原子序数的增加,半径逐渐减小,同主族元素的原子半径随着原子序数的增加,电子层数增多,原子半径增加,故N、Na、P的原子半径由小到大的顺序是N<P<Na;
(6)元素e为O元素、元素i为S元素,H2S与O2反应生成S单质,这个反应能证明S的非金属性比O的非金属性强,反应方程式为2H2S+O2![]() 2H2O+S;
2H2O+S;
(7)d的简单氢化物的为NH3,h的简单氢化物PH3,NH3分子间可以形成氢键,而PH3分子间不能形成氢键,所以NH3的沸点比PH3的沸点高;元素j为Cu元素,Cu元素的原子序数为29,其原子结构示意图为 ;
;

【题目】补齐下列物质间的反应与对应反应类型的连线。
A. 从乙烯得到聚乙烯的反应 | a. 氧化反应 |
B. 乙醇与酸性重铬酸钾溶液反应 | b. 加聚反应 |
C. 乙烯与溴的四氯化碳溶液反应 | c. 取代反应 |
D. 乙酸和乙醇在浓硫酸作用下的反应 | d. 加成反应 |