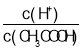题目内容
【题目】硫代硫酸钠(Na2S2O3)为白色结晶粉末,易溶于水,在中性或碱性条件下稳定,在酸性条件下发生反应(S2O32-+2H+=S↓+SO2+H2O),是一种重要的化工原料。请回答下列问题:
(1)Na2S2O3溶液可用作照相底片(AgBr)中的定影剂,其原理是将未感光的AgBr转化为可溶于水的稳定络合物Na3[Ag(S2O3)2]。写出该络合反应的离子方程式___。
(2)工业上利用硫化碱残渣(主要成分Na2S,Na2CO3)与硫黄废气(主要成分SO2)反应,经吸硫、蒸发、结晶,制得硫代硫酸钠。巳知该反应中C(碳)原子化合价不变,则氧化剂和还原剂物质的量之比为___。
(3)Na2S2O3长期暴露在空气中易被氧化生成Na2SO4,设计实验方案检验Na2S2O3是否变质(已知BaS2O3微溶于水)___。
(4)现有含Na2S2O3·5H2O的样品,用以下方法计算Na2S2O3·5H2O的质量分数。
a.取样品7.0g溶于蒸馏水中,并定容至500mL容量瓶中待用。
b.取0.01mol.L-1的K2Cr2O7标准溶液20.00mL于锥形瓶中,加过量KI溶液并酸化,加2滴淀粉指示剂,用a中未知浓度的Na2S2O3待测液滴定至终点,共用去25.00mL。(已知2S2O32-+I2=S4O62-+2I-),在酸性环境中Cr2O72-被还原为绿色的Cr3+)。
回容下列问题:
①滴定终点的现象是___。
②样品中Na2S2O3·5H2O的质量分数为___(保留2位有效数字)。
【答案】2S2O32- + AgBr = [Ag(S2O3)2]3- + Br- 2:1 取少量样品于试管中,加过量稀盐酸,充分反应后,静置,向上层清液中加入氯化钡溶液,若有白色沉淀生成,则已氧化变质,反之,则未氧化变质 滴入最后一滴待测液,溶液蓝色变为浅绿色,且半分钟内不恢复 85%
【解析】
⑴根据题中信息可以写出方程式;
⑵利用氧化还原反应中得失电子守恒分析得出;
⑶检验Na2S2O3是否氧化变质,只要检验硫代硫酸钠中是否含Na2SO4;
⑷重铬酸根和碘离子反应生成单质碘,加入淀粉变为蓝色,用硫代硫酸钠滴定单质碘,最终碘单质完全消耗,蓝色消失;利用关系式确定重铬酸根和硫代硫酸根之间比例关系,计算即可。
⑴Na2S2O3溶液将未感光的AgBr转化为可溶于水的稳定络合物Na3[Ag(S2O3)2]。该络合反应的离子方程式2S2O32-+ AgBr=[Ag(S2O3)2]3-+ Br-,
故答案为2S2O32-+ AgBr=[Ag(S2O3)2]3-+ Br-;
⑵工业上利用硫化碱残渣(主要成分Na2S,Na2CO3)与硫黄废气(主要成分SO2)反应,经吸硫、蒸发、结晶,制得硫代硫酸钠,已知该反应中C(碳)原子化合价不变,Na2S中S的化合价由-2价升至+2价,Na2S为还原剂,SO2中S的化合价由+4价降至+2价,SO2为氧化剂,根据得失电子守恒,氧化剂SO2与还原剂Na2S物质的量之比为2:1,
故答案为2:1;
⑶Na2S2O3长期暴露在空气中易被氧化生成Na2SO4,要检验Na2S2O3是否变质即检验Na2S2O3中是否含Na2SO4,由于BaS2O3微溶于水,所以加BaCl2溶液之前先用HCl排除Na2S2O3的干扰,则实验方案为:取少量样品于试管中,加过量稀盐酸,充分反应后,静置,向上层清液中加入氯化钡溶液,若有白色沉淀生成,则已氧化变质,反之,则未氧化变质;
故答案为:取少量样品于试管中,加过量稀盐酸,充分反应后,静置,向上层清液中加入氯化钡溶液,若有白色沉淀生成,则已氧化变质,反之,则未氧化变质;
⑷①滴定前溶液呈蓝色,滴定终点I2被完全消耗,蓝色消失,因此滴定终点的现象是:滴入最后一滴待测液,蓝色变为浅绿色,且半分钟内不恢复,
故答案为滴入最后一滴待测液,蓝色变为浅绿色,且半分钟内不恢复;
②K2Cr2O7与I-反应的方程式为Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2与Na2S2O3的反应为I2+2S2O32-=S4O62-+2I-,得出关系式:

解得n = 1.2×10-3 mol,
因此总的物质的量为n = 1.2×10-3 mol×![]() =2.4×10-2 mol,
=2.4×10-2 mol,
质量分数ω=![]() ×100%=85%,
×100%=85%,
故答案为85%。