题目内容
【题目】同学们课外探究酸的性质活动中将以下8个实验分为三组进行(如下图所示)。
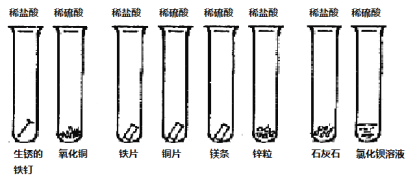
① ② ③ ④ ⑤ ⑥ ⑦ ⑧
(1)这8个实验是如何分组的?请写出各组的试管编号:第一组 第二组 第三组 ,你认为如此分组的依据是: 。
(2)写出试管②⑤的实验现象及有关的离子方程式:
② ; 。
⑤ ; 。
(3)请作为课外活动小组成员,根据实验及现象的分析、比较,归纳出的结论(至少答3条):
①___________________________________;
②___________________________________;
③____________________________________。
【答案】(1)第一组①②;第二组③④⑤⑥ ;第三组⑦⑧ ; 因为本实验的目的是研究强酸(盐酸和硫酸)分别与金属氧化物、金属、盐的反应,所以如此分类
(2)②固体溶解,得到蓝色的溶液;CuO+2H+=Cu2++H2O。
⑤镁条溶解,产生大量气体;Mg+2H+=Mg2++H2↑
(3)(共3分写出其中三个点给满分)①酸能跟某些金属氧化物反应;②酸能跟某些盐反应;③酸能跟多种活泼金属反应;④酸并不能跟所有金属反应;⑤酸与活泼金属反应时速度不同
【解析】
试题分析:(1)本实验的目的是探究酸的性质,①中生锈的铁钉主要成分是氧化铁,是氧化物,②中氧化铜是氧化物,③中铁片是金属,④中铜片是金属,⑤中镁条是金属,⑥中锌粒是金属,⑦中石灰石是盐,⑧中氯化钡是盐,根据与酸反应的类别,分为氧化物、金属、盐;
(2)②氧化铜与稀硫酸反应,生成硫酸铜和水,所以氧化铜固体溶解,生成的硫酸铜中铜离子的颜色为蓝色,反应的离子方程式为CuO+2H+=Cu2++H2O;
⑤镁条为金属单质,它和稀硫酸反应生成硫酸镁和氢气,所以镁条溶解,有气体生成,反应的离子方程式为Mg +2H+=Mg2++H2↑;
(3)在复分解反应中,若生成物中有水或气体或沉淀生成时,将会使生成物中的离子浓度减小,反应持续进行,探究酸的性质,须考虑酸能否与与之发生复分解反应,所以考虑酸与金属、氧化物、与某些盐反应。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表是某食品包装上的说明,表中列出了部分配料。
品 名 | 乐百氏 |
部分配料 | ① 奶粉 ②白砂糖③ 乳酸钙 ④ 山梨酸钾 |
生产日期 | 标于包装封口处 |
配料中,富含蛋白质的是____(填序号,下同),属于营养强化剂的是___,属于防腐剂的是______。
