题目内容
【题目】在一体积固定为10L的密闭恒温容器中充入1.5mol氨气,发生反应:2NH3(g)![]() N2(g)+3H2(g) △H=93KJ/mol
N2(g)+3H2(g) △H=93KJ/mol
反应容器中NH3物质的量随时间的变化如下图所示:
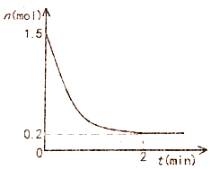
(1)2min时反应进入化学平衡状态,此时容器内物质浓度c(H2)=______mol/L。
(2)0~2min内以NH3表示的平均反应速率v(NH3)=________mol/(L·min)。
(3)依图中曲线判断、0~2min内NH3分解反应是_____(填“先快后慢”或“先慢后快”或“匀速进行”)。
(4)容器内起始时与平衡时的压强比为___________。
【答案】(1)0.195;
(2)0.065;
(3)先快后慢;
(4)15:28;
【解析】
试题分析:(1)根据2NH3(g)![]() N2(g)+3H2(g),2min时氨气剩余0.2mol,反应的氨气的物质的量为1.5mol-0.2mol=1.3mol,生成氢气的物质的量为
N2(g)+3H2(g),2min时氨气剩余0.2mol,反应的氨气的物质的量为1.5mol-0.2mol=1.3mol,生成氢气的物质的量为![]() ×1.3mol=1.195mol,c(H2)=
×1.3mol=1.195mol,c(H2)=![]() =0.195mol/L,故答案为:0.195;
=0.195mol/L,故答案为:0.195;
(2)0~2min内以NH3表示的平均反应速率v(NH3)=  =0.065mol/(L·min),故答案为:0.065;
=0.065mol/(L·min),故答案为:0.065;
(3)0~2min内随着NH3的分解氨气的浓度逐渐减小,反应速率逐渐减慢,故答案为:先快后慢;
(4)根据方程式可知,气体物质的量的增大量等于反应的氨气的物质的量,根据同温同体积时,气体的压强之比等于物质的量之比,容器内起始时与平衡时的压强比为![]() =
=![]() ,故答案为:15:28。
,故答案为:15:28。

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目