题目内容
【题目】请阅读下列材料,完成下面小题。
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。其工业合成原理为:
①2Fe(OH)3+3NaClO+10NaOH=2Na2FeO4+6NaCl+8H2O
②Na2FeO4+2KOH![]() K2FeO4↓+2NaOH
K2FeO4↓+2NaOH
高铁酸钾与水反应生成Fe(OH)3胶体和氧气等。
【1】关于反应①下列说法正确的是
A.Fe(OH)3得到电子B.NaClO失去电子
C.NaClO被还原D.NaOH是氧化剂
【2】反应②属于
A.化合反应B.分解反应C.置换反应D.复分解反应
【3】关于反应②下列说法正确的是
A.减小Na2FeO4浓度能够加快反应速率
B.增大KOH浓度能够加快反应速率
C.升高温度可以减慢反应速率
D.加入足量的KOH可以使Na2FeO4100%转化为K2FeO4
【4】NaClO属于
A.氧化物B.酸C.碱D.盐
【答案】
【1】C
【2】D
【3】B
【4】D
【解析】
在反应①次氯酸钠将氢氧化铁氧化成高铁酸钠,自身被还原为氯化钠,根据化合价的变化分析,每生成1molNa2FeO4,有1molFe(OH)3参加反应,转移3mol电子;反应②是复分解反应,因为高铁酸钾的溶解度更小,以沉淀形式生成,所以满足发分解反应的发生条件。
【1】由上述分析可知,Fe(OH)3失去电子,NaClO得到电子,NaClO被还原,NaOH既不是氧化剂也不是还原剂。
答案选C。
【2】反应②属于复分解反应,因为高铁酸钾的溶解度更小,以沉淀形式生成,所以满足发分解反应的发生条件。
答案选D。
【3】A、减小Na2FeO4浓度可以使化学反应速率减小,故A错误;
B、反应物浓度增大,反应速率加快,故B正确;
C、升高温度加快反应速率,故C错误;
D、可逆反应有一定的限度,即使加入足量的KOH, Na2FeO4也不能100%转化为K2FeO4,故D错误。
答案选B。
【4】NaClO由阳离子钠离子和酸根阴离子次氯酸根构成,属于盐。
答案选D。

【题目】甲、乙两个实验小组利用![]() 酸性溶液与
酸性溶液与![]() 溶液反应研究影响反应速率的因素。
溶液反应研究影响反应速率的因素。
设计实验方案如下![]() 实验中所用
实验中所用![]() 溶液均已加入
溶液均已加入![]() :
:
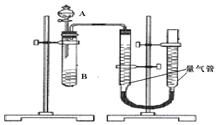
甲组:通过测定单位时间内生成![]() 气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
气体体积的大小来比较化学反应速率的大小某同学进行实验,实验装置如图.其中A、B的成分见表
序号 | A溶液 | B溶液 |
① |
|
|
② |
|
|
③ |
|
|
![]() 该反应的离子方程式为 ______
该反应的离子方程式为 ______
![]() 实验开始前需要检查气密性.分液漏斗中A溶液应该 ______ 加入
实验开始前需要检查气密性.分液漏斗中A溶液应该 ______ 加入![]() 填“一次性”或“逐滴滴加”
填“一次性”或“逐滴滴加”![]()
![]() 完成该实验还需要 ______
完成该实验还需要 ______ ![]() 填仪器名称
填仪器名称![]() ,实验结束后读数前需要移动量气管,使两个量气管的液面相平.
,实验结束后读数前需要移动量气管,使两个量气管的液面相平.
乙组:通过测定![]() 溶液褪色所需时间的多少来比较化学反应速率为了探究
溶液褪色所需时间的多少来比较化学反应速率为了探究![]() 与
与![]() 浓度对反应速率的影响,某同学在室温下完成以下实验
浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水 | 10 | 5 | 0 | X |
| 5 | 10 | 10 | 5 |
| 5 | 5 | 10 | 10 |
时间 | 40 | 20 | 10 | --- |
![]() ______ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是 ______ 。
______ ,4号实验中始终没有观察到溶液褪色,你认为可能的原因是 ______ 。
![]() 号反应中,
号反应中,![]() 的反应速率为 ______。
的反应速率为 ______。
![]() 在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
在实验中发现高锰酸钾酸性溶液和草酸溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.某同学认为是放热导致溶液温度升高所致,重做3号实验,测定过程中溶液不同时间的温度,结果如表:
时间 | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
温度℃ | 25 | 26 | 26 | 26 |
| 27 | 27 |
结合实验目的与表中数据,你得出的结论是 ______。
![]() 从影响化学反应速率的因素看,你的猜想还可能是 ______ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是 ______
从影响化学反应速率的因素看,你的猜想还可能是 ______ 的影响。若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是 ______ ![]() 填字母
填字母![]() 。
。
A 硫酸钾![]() 水
水![]() 二氧化锰
二氧化锰![]() 硫酸锰。
硫酸锰。