��Ŀ����
����Ŀ��������Ⱦ��NOͨ���ú�Ce4+����Һ���գ�����HNO2��NO3-�������õ�ⷨ����������Һ�е�HNO2ת��Ϊ�����ʣ�ͬʱ����Ce4+����ԭ����ͼ��ʾ������˵����ȷ���ǣ� ��
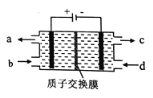
A. H+�����ҽ�������
B. Ce4+�ӵ��۵�c���������ҿ�ѭ��ʹ��
C. �����ĵ缫��Ӧʽ:2HNO2+6H+-6e-=N2��+4H2O
D. ���ü���ȼ�ϵ����Ϊ��Դ�������ı�״����33.6L����ʱ�������Ͽ�ת��2molHNO2
���𰸡�A
�����������������Դ���������ĵ缫������������ʧȥ���ӵ�������Ӧ�����Դ���������ĵ缫�������������õ����ӵĻ�ԭ��Ӧ���ݴ˽��
A�����缫���������������������������ƶ������ݵ��ԭ����H���������������ƶ���A��ȷ��
B��������Ⱦ��NOͨ���ú�Ce4����Һ���գ�����HNO2��NO3����N�Ļ��ϼ����ߣ�Ce4���Ļ��ϼ۽��ͣ�Ȼ��Դ���Һ���е�⣬�ֲ���Ce4�������ݵ��ԭ����Ӧ�������ϲ�������Ce4����a����������ѭ��ʹ�ã�B����
C�����ݵ��ԭ���������ϵõ��ӣ����ϼ۽��ͣ�HNO2ת��Ϊ�����ʣ���ת��ΪN2�������缫��ӦʽΪ2HNO2��6H����6e��=N2����4H2O��C����
D�������33.6L��������ʵ�����1.5mol�����뷴Ӧת�Ƶ������ʵ���Ϊ1.5mol��8=12mol��1mol������õ�3mol���ӣ���������Ͽ�ת��HNO2�����ʵ���Ϊ12mol��3=4mol��D����
��ѡA��

����Ŀ����������������Ӧ����㷺�����������ͺ����²��ϵ�Ӧ�ñ��ܹ�ע��
(1)��¯������ұ��������Ҫ��������������Ҫ��Ӧ��:
��Ӧ | ��H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | K2 |
iii. C(s)+CO2(g) | +172 | K3 |
�Լ��㣬X=_____��K1��K2��K3֮��Ĺ�ϵΪ____________��
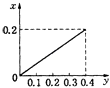
(2)T1��ʱ,��ij�����ܱ������м���һ������Fe2O3��C��������Ӧi����Ӧ�ﵽƽ�����t1ʱ��,�ı�ij����,V(��)��ʱ��(t)�ı仯��ϵ��ͼ1��ʾ����t1ʱ�̸ı������������_____(��д��ĸ)��
a.�����¶Ȳ���,ѹ������ b.����������䣬�����¶�
c.�����������,������̼�� d.�����������,����COŨ��
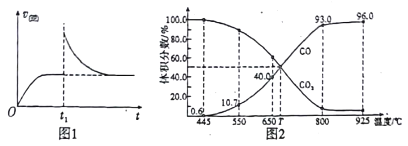
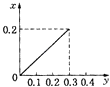
(3)��һ���¶��£���ij����ɱ�ĺ�ѹ�ܱ�����(p��)����1molCO2 ��������̼��������Ӧ����ƽ��ʱ��ϵ����������������¶ȵĹ�ϵ��ͼ2 ��ʾ��
��650��ʱ,�÷�Ӧ��ƽ������յ�������______��(����ʱ�������¶ȶԡ�H��Ӱ��)
��T��ʱ,����ƽ����ϵ���ٳ���һ������V(CO2):V(CO) =5:4�Ļ�����壬ƽ��_____(� ������ ���� ���� )�ƶ���
��925��ʱ,��ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��KpΪ_____��[�����ѹ(p��)=������ѹ(p��) �������������ij���ʵ�ƽ���ѹ�������ʵ���Ũ��Ҳ���Ա�ʾ��ѧƽ�ⳣ��������Kp]
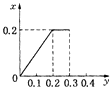
(4)��ԭ���ԭ�����Գ�ȥ���Է�ˮ�е�������ϩ��AsO3-����ԭ����ͼ3��ʾ( ������ڲ�Ϊ���������)��
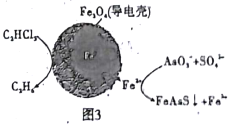
�ڳ��۹����У�����������е�FeΪԭ��ص�______�� (���"����)��д��C2HCl3������汻��ԭΪ����ĵ缫��ӦʽΪ_____________��