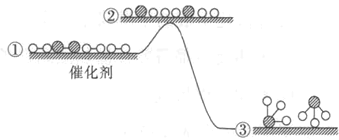
��Ŀ����
����Ŀ���������ó��ս��ì�ܼ�����Ҳ�����ǿ������й��뵼���ҵ���ڵ����㣬��˵�������Σ�Ϊʱδ�������ҳ����ڵIJ��㣬Ȼ����Ե�ȥ������⣬�����ð뵼���ҵ����չ׳�����������Ȼ�����(POCl3)��һ����Ҫ�Ļ���ԭ�ϣ��������뵼����Ӽ������άԭ�ϡ�һ�о�С����ʵ����ģ�ⷴӦ![]() �Ʊ�POCl3���ⶨ��Ʒ������
�Ʊ�POCl3���ⶨ��Ʒ������
���Ͽ�Ƭ��
���� | �۵㣯�� | �е㣯�� | ��Է������� | ���� |
PCl3 | -93.6 | 76.1 | 137.5 | ��ˮ����ˮ�⣬����O2��Ӧ |
POCl3 | 1.25 | 105.8 | 153.5 | ��ˮ����ˮ�⣬������PCl3 |
SOCl2 | -105 | 78.8 | 119 | ��ˮ����ˮ�⣬�����ֽ� |
��1����ѡ��Na2SO3������70��ŨH2SO4��ȡSO2����Ӧ�Ļ�ѧ����ʽ�ǣ�____________��
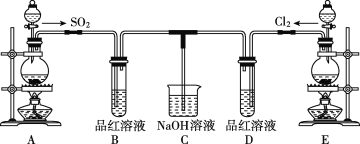
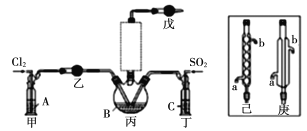
��2����ҺAΪ����ʳ��ˮ����װ����Ӧ��ʢװ���Լ�Ϊ__________(����P2O5��������ʯ��������ŨH2SO4��������ˮ����ͭ��)����Ӧװ��ͼ�������δ�������������ѡ��______(����������������)��
��3���ס���װ�õ����ó�����������ľ��������⣬����________________��
��4��ˮԡ����������ƿ�����Ʒ�Ӧ�¶���60��65�棬��ԭ����___________��
��5��ͨ��������·��ɲⶨ�����ᴿ��IJ�Ʒ��POCl3�ĺ�����ȷ��ȡ1��600g��Ʒ��ˮ��ƿ��ҡ������ȫˮ�⣬��ˮ��Һ���100 mL��Һ��ȡ10��00 mL����ƿ�У�����0��2000 mol��L-1��AgNO3��Һ20��00 mL(Ag++C1- AgC1��)���ټ�������������������ʹ�������л��︲�ǡ�����NH4Fe(SO4)2��ָʾ������0��1000 mol��L-1KSCN����Һ�ζ�������AgNO3���յ�(Ag++SCN- AgSCN��)����ƽ��ʵ�飬ƽ������KSCN����Һ10��00 mL��
�ٴﵽ�ζ��յ��������____________��
��POCl3����������Ϊ___________��
����֪��KSP(AgC1)=3
���𰸡�Na2SO3+H2SO4 �TNa2SO4 +SO2��+H2O P2O5 �� ͨ���۲�������ݵ����ʿ���ͨ����������� �¶�̫�ͣ���Ӧ����̫�����¶�̫�ߣ�PCl3�����ʻӷ� �������һ��KSCN����Һ����Һ���ɫ���Ұ�����ڲ���ɫ 95.9�� ƫС
��������
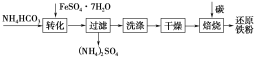
��ʵ��װ��ͼ��ʵ��ԭ����֪��װ��A����ʢ�б���ʳ��ˮ����ȥ�����л��е��Ȼ��⣬װ������ʢ�����Թ����������������ף�����������װ�ö���ʢ��Ũ���ᣬ�����������װ�ñ�Ϊ���Ȼ������Ʊ�װ�ã�װ�������������ܵ������������������Ȼ����ף���ֹ���Ȼ��������Ȼӷ���ʢ�м�ʯ�ҵĸ���ܵ�����������δ��Ӧ�������Ͷ�������ֹ��Ⱦ������ͬʱ���տ�����ˮ��������ֹˮ��������������ƿ�е������Ȼ�����ˮ�⡣
��1��Na2SO3������70��ŨH2SO4��Ӧ���������ơ����������ˮ����Ӧ�Ļ�ѧ����ʽΪNa2SO3+H2SO4 �TNa2SO4 +SO2��+H2O���ʴ�Ϊ��Na2SO3+H2SO4 �TNa2SO4 +SO2��+H2O��
��2����ҺA�б���ʳ��ˮ�������dz�ȥ�����л��е��Ȼ��⣬װ������ʢ�����Թ����������������ף�������������ֹˮ��������������ƿ�е������Ȼ�����ˮ�⣻װ�������������ܵ������������������Ȼ��ף���ֹ���Ȼ��ס����Ȼ��������Ȼӷ����������Ȼ����IJ��ʣ�Ϊ��ǿ����Ч������ѡ��ֱ�������ܣ��ʴ�Ϊ��P2O5������
��3���ס���װ�õ����ó�����������ľ��������⣬�������۲�������ݵ����ʿ���ͨ����������٣������ڷ�Ӧ��ֽ��У��ʴ�Ϊ��ͨ���۲�������ݵ����ʿ���ͨ����������٣�
��4�������¶�̫�ͣ���Ӧ����̫�������¶�̫�ߣ�PCl3���������Ȼӷ����������Ȼ����IJ��ʣ�����ʵ��ʱ��ˮԡ����������ƿ�����Ʒ�Ӧ�¶���60��65�����ʴ�Ϊ���¶�̫�ͣ���Ӧ����̫�����¶�̫�ߣ�PCl3�����ʻӷ���
��5�����������֪���ⶨPOCl3��Ʒ����ʱ��NH4Fe(SO4)2��ҺΪָʾ������KSCN��Һ�ζ�������AgNO3��Һ���ﵽ�յ�ʱ�������ǵ������һ��KSCN����Һ����Һ���ɫ���Ұ�����ڲ���ɫ���ʴ�Ϊ���������һ��KSCN����Һ����Һ���ɫ���Ұ�����ڲ���ɫ��
��KSCN�����ʵ���Ϊ0.1mol/L��0.01L=0.001mol�����ݷ�ӦAg++SCN-=AgSCN������֪��Һ��ʣ��������ӵ����ʵ���Ϊ0.001mol������POCl3��ˮ��Ӧ�����Ȼ���������ӵ����ʵ���Ϊ��0.004mol ��0.001mol��=0.003mol��ˮ�����ɵ��Ȼ�������ʵ���Ϊ0.003mol���������֪1.600g��Ʒ��POCl3�����ʵ���Ϊ![]() ��10=0.01mol�����Բ�Ʒ��POCl3����������Ϊ
��10=0.01mol�����Բ�Ʒ��POCl3����������Ϊ![]() ��100%=95.9%���ʴ�Ϊ��95.9%��
��100%=95.9%���ʴ�Ϊ��95.9%��
��������������������ʹ���ɵ��Ȼ��������뿪��Һ�������������������ˮ��Һ�в����Ȼ�������ת����AgSCN����֪Ksp��AgCl��>Ksp��AgSCN����ʹ��ʵ�������ĵ�AgSCNƫ�࣬���ݣ�7���ļ���ԭ����֪����ʹ�ⶨ�����ƫ�ͣ��ʴ�Ϊ��ƫ�͡�