题目内容
【题目】铁及其化合物在日常生活中有广泛应用。
(1)写出Fe(OH)2转化为Fe(OH)3的化学方程式:__________________。
(2)绿矾(FeSO4·7H2O)是补血剂的原料,易变质。检验绿矾是否变质的试剂是________。设计实验检验绿矾是否完全变质:________________。
(3)(I)利用绿矾制备还原铁粉的工业流程如下:
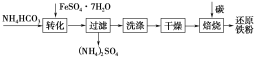
①干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O在空气中被氧化为FeOOH,该反应的化学方程式为_____________________。
②取干燥后的FeCO3样品12.49 g,焙烧,最终得到还原铁粉6.16 g,计算样品中杂质FeOOH的质量为________g。(FeOOH也能被C还原得到Fe)
(II)用下列方法可制得Fe(OH)2白色沉淀:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
①用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________。
②除去蒸馏水中溶解的O2常采用________的方法。
③生成白色沉淀Fe(OH)2的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_________________。
【答案】4Fe(OH)2+O2+2H2O=4Fe(OH)3 KSCN溶液 取绿矾溶于水形成溶液,然后加入酸性KMnO4溶液,若紫色不褪色,说明绿矾完全变质 4FeCO3·nH2O+O2=4FeOOH+4CO2+(4n-2)H2O 0.89 稀硫酸、铁屑 煮沸 避免生成的Fe(OH)2沉淀接触O2被氧化为Fe(OH)3
【解析】
(1)Fe(OH)2与O2、H2O反应,生成Fe(OH)3。
(2)若绿矾变质,则Fe2+转化为Fe3+,利用KSCN可检验Fe3+。检验绿矾完全变质,则需检验Fe2+不存在。
(3)(I)①FeCO3·nH2O在空气中被氧化为FeOOH,该反应为4FeCO3·nH2O+O2=4FeOOH+4CO2+(4n-2)H2O。
② n(Fe)=![]() ,设FeOOH的物质的量为x
,设FeOOH的物质的量为x
则有89x+116(0.11-x)=12.49,x=0.01mol,从而得出FeOOH的质量。
(II)①用硫酸亚铁晶体配制上述FeSO4溶液时,需防止Fe2+的水解和氧化,所以需加入抑制水解和防止被氧化剂的试剂。
②除去蒸馏水中溶解的O2常采用煮沸的方法。
③生成白色沉淀Fe(OH)2的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由在整个操作过程中不引入O2,避免Fe(OH)2沉淀被氧化。
(1)Fe(OH)2与O2、H2O反应,生成Fe(OH)3,反应的方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(2)若绿矾变质,则Fe2+转化为Fe3+,利用KSCN可检验Fe3+。检验绿矾完全变质,则需检验Fe2+不存在,可加入酸性KMnO4溶液。答案为:KSCN溶液;取绿矾溶于水形成溶液,然后加入酸性KMnO4溶液,若紫色不褪色,说明绿矾完全变质;
(3)(I)①FeCO3·nH2O在空气中被氧化为FeOOH,该反应为4FeCO3·nH2O+O2=4FeOOH+4CO2+(4n-2)H2O。答案为:4FeCO3·nH2O+O2=4FeOOH+4CO2+(4n-2)H2O;
② n(Fe)=![]() ,设FeOOH的物质的量为x
,设FeOOH的物质的量为x
则有89x+116(0.11-x)=12.49,x=0.01mol,从而得出FeOOH的质量为0.01mol×89g/mol=0.89g。答案为:0.89;
(II)①用硫酸亚铁晶体配制上述FeSO4溶液时,需防止Fe2+的水解和氧化,所以需加入抑制水解的试剂稀硫酸、防止被氧化剂的试剂铁屑。答案为:稀硫酸、铁屑;
②除去蒸馏水中溶解的O2常采用煮沸的方法。答案为:煮沸;
③生成白色沉淀Fe(OH)2的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由在整个操作过程中不引入O2,避免Fe(OH)2沉淀被氧化。答案为:避免生成的Fe(OH)2沉淀接触O2被氧化为Fe(OH)3。

【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
【题目】物质A~D均含同种元素,都是中学化学中常见的物质,它们之间可发生如图所示的反应(除A~D外的其他物质均已略去)。
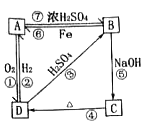
(1)写出相应物质的类别。
物质 | B | C | D |
类别 | ___ | __ | __ |
(2)上述反应①到⑥中,属于离子反应的有___个。
(3)①D→A转化的化学方程式:__。
②B→C转化的离子方程式:__。
【题目】这次中美贸易战的矛盾激化,也让我们看到了中国半导体产业存在的诸多不足,俗话说“亡羊补牢,为时未晚”,找出存在的不足,然后针对地去解决问题,才能让半导体产业链发展壮大起来。三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室模拟反应![]() 制备POCl3并测定产品含量。
制备POCl3并测定产品含量。
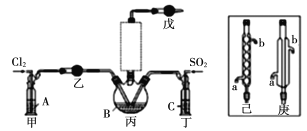
资料卡片:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -93.6 | 76.1 | 137.5 | 遇水剧烈水解,易与O2反应 |
POCl3 | 1.25 | 105.8 | 153.5 | 遇水剧烈水解,能溶于PCl3 |
SOCl2 | -105 | 78.8 | 119 | 遇水剧烈水解,受热易分解 |
(1)若选用Na2SO3固体与70%浓H2SO4制取SO2,反应的化学方程式是:____________。
(2)溶液A为饱和食盐水,乙装置中应该盛装的试剂为__________(填“P2O5”或“碱石灰”或“浓H2SO4”或“无水硫酸铜”);反应装置图的虚框中未画出的仪器最好选择______(填“己”或“庚”)。
(3)甲、丁装置的作用除了用于气体的净化除杂外,还有________________。
(4)水浴加热三颈烧瓶,控制反应温度在60~65℃,其原因是___________。
(5)通过佛尔哈德法可测定经过提纯后的产品中POCl3的含量:准确称取1.600g样品在水解瓶中摇动至完全水解,将水解液配成100 mL溶液,取10.00 mL于锥形瓶中,加入0.2000 mol·L-1的AgNO3溶液20.00 mL(Ag++C1- AgC1↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000 mol·L-1KSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN- AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00 mL。
①达到滴定终点的现象是____________。
②POCl3的质量分数为___________。
③已知:KSP(AgC1)=3