��Ŀ����
����Ŀ������ҵβ��SO2��NO2����Ⱦ�������γ������������ס���ش��������⣺������(��ѧʽ��HNCO��CΪ+4��)����������β���е�NO2���䷴Ӧԭ��Ϊ��HNCO+NO2��N2+CO2+![]() (δ��ƽ)��
(δ��ƽ)��
��������Ӧ����������____________��
����ƽ����Ӧ��д____________��
��ÿ����33.6LNO2(��״��)����Ӧ��ת�Ƶ��ӵ���ĿΪ____________��
����Ϊ�˼���CO�Դ�������Ⱦ��ij�о���ѧϰС�����о�����CO��H2O��Ӧת��Ϊ��ɫ��ԴH2����֪��2CO��g��+O2��g���T2CO2��g����H=��566.0kJ mol��1��2H2��g��+O2��g���T2H2O��g����H=��483.6kJ mol��1��2H2O��g���TH2O��l����H=��44.0kJ mol��1��
��1��д��CO��H2O��g����������CO2��H2���Ȼ�ѧ����ʽ��____________��
��2�������Ǻϳɰ�����Ҫԭ�ϣ��ϳɰ���Ӧ���Ȼ�ѧ����ʽ���£�N2��g��+3H2��g��![]() 2NH3��g����H=��92.4kJmoL��1��
2NH3��g����H=��92.4kJmoL��1��
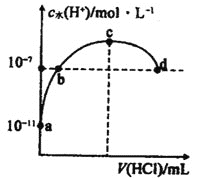
�ٵ��ϳɰ���Ӧ�ﵽƽ��ı�ijһ������������ı�N2��H2��NH3����������Ӧ������ʱ��Ĺ�ϵ��ͼ��ʾ��ͼ��t3ʱ����ƽ���ƶ�������������______�����б�ʾƽ��������NH3�ĺ�����ߵ�һ��ʱ����______��

���¶�ΪT��ʱ����1mol N2��2mol H2�����ݻ�Ϊ0.5L���ܱ������У���ַ�Ӧ����N2��ƽ��ת����Ϊ50%����Ӧ��T��ʱ��ƽ�ⳣ��Ϊ______mol��2L2��
��Ŀǰ��ҵ�ϳɰ���ԭ���ǣ�N2+3H2![]() 2NH3��ͼ��ʾ�������ı䣬ƽ����ϵ�а�����������ı仯���ƣ���������Ϊѹǿʱ���仯������ȷ���ǣ�����ţ���ͬ��___����������Ϊ�¶�ʱ���仯������ȷ����___��
2NH3��ͼ��ʾ�������ı䣬ƽ����ϵ�а�����������ı仯���ƣ���������Ϊѹǿʱ���仯������ȷ���ǣ�����ţ���ͬ��___����������Ϊ�¶�ʱ���仯������ȷ����___��

��3�������°�����HCl����������ˮ���ֽ���ͬ�������ͬ���ʵ���Ũ�ȵİ�ˮ�������ϣ�������Һ�и����ӵ����ʵ���Ũ�Ȱ����ɴ�С��˳����������Ϊ____��____��____��____��
���𰸡�NO2 4H2O 6NA CO��g��+H2O��g���TCO2��g��+H2��g����H=��41.2kJ/mol �����¶� t2��t3 4 c a c��Cl���� c��NH4+�� c��H+�� c��OH����
��������
����HNCO��CΪ+4�ۣ���Ԫ���ǣ�3�ۣ����ݷ���ʽ��֪����Ӧ��NO2�е�Ԫ����+4�۽��͵�0�ۣ��õ�4�����ӣ�NO2����������HNCO�е�Ԫ���ɣ�3�����ߵ�0�ۣ�ʧȥ3�����ӣ�HNCO�ǻ�ԭ����
����1���ɸ�˹���ɼ���ɵã�
��2���ٺϳɰ���ӦΪ���������С�ķ��ȷ�Ӧ������ѹǿ�����淴Ӧ���ʾ�����ƽ��������Ӧ�����ƶ����ﵽ��ƽ��ʱƽ��������NH3�ĺ������������¶ȣ����淴Ӧ���ʾ�����ƽ�����淴Ӧ�����ƶ����ﵽ��ƽ��ʱƽ��������NH3�ĺ�����С��ʹ�ô��������淴Ӧ���ʾ�����ƽ�ⲻ�ƶ���ƽ��������NH3�ĺ������䣻
�ڽ�������ʽ����������ʽ���ݼ��㻯ѧƽ�ⳣ����
�ۺϳɰ���ӦΪ���������С�ķ��ȷ�Ӧ������ѹǿ��ƽ��������Ӧ�����ƶ��������¶ȣ�ƽ�����淴Ӧ�����ƶ���
��3����ͬ�������ͬ���ʵ���Ũ�ȵİ�ˮ������ǡ����ȫ��Ӧ�����Ȼ�泥��Ȼ������Һ��ˮ��ʹ��Һ�����ԡ�
����HNCO��CΪ+4�ۣ���Ԫ���ǣ�3�ۣ����ݷ���ʽ��֪����Ӧ��NO2�е�Ԫ����+4�۽��͵�0�ۣ��õ�4�����ӣ�NO2����������HNCO�е�Ԫ���ɣ�3�����ߵ�0�ۣ�ʧȥ3�����ӣ�HNCO�ǻ�ԭ�������ݵ��ӵ�ʧ�غ��֪�������뻹ԭ�������ʵ���֮����3:4������ԭ���غ��֪��Ӧ����ˮ���ɣ���Ӧ�Ļ�ѧ����ʽΪ8HNCO+6NO2��7N2+CO2+4H2O����״��33.6LNO2�����ʵ���Ϊ![]() =1.5mol����Ӧת�Ƶĵ�����ĿΪ1.5mol��4NA mol��1=6NA���ʴ�Ϊ��NO2��4H2O��6NA��
=1.5mol����Ӧת�Ƶĵ�����ĿΪ1.5mol��4NA mol��1=6NA���ʴ�Ϊ��NO2��4H2O��6NA��
����1����֪����2CO��g��+O2��g��=2CO2��g����H=-566kJmoL-1��2H2��g��+O2��g��=2H2O��g����H=-483.6KJmoL-1�����ݸ�˹���ɣ���-�ڵ�2CO��g��+2H2O��g��=2H2��g��+2CO2��g�������H=-566kJmoL-1-��-483.6kJmoL-1��=-82.4kJmoL-1����Ӧ���Ȼ�ѧ����ʽΪCO��g��+H2O��g��=H2��g��+CO2��g����H=-41.2kJmoL-1���ʴ�Ϊ��CO��g��+H2O��g��=H2��g��+CO2��g����H=-41.2kJmoL-1��
��2���ٺϳɰ���ӦΪ���������С�ķ��ȷ�Ӧ����ͼ��֪��t1ʱ����ѹǿ�����淴Ӧ���ʾ���������Ӧ���ʴ����淴Ӧ���ʣ�˵��ƽ��������Ӧ�����ƶ����ﵽ��ƽ��ʱƽ��������NH3�ĺ�������t3ʱ�����¶ȣ����淴Ӧ���ʾ������淴Ӧ���ʴ�������Ӧ���ʣ�˵��ƽ�����淴Ӧ�����ƶ����ﵽ��ƽ��ʱƽ��������NH3�ĺ�����С��t5ʱʹ�ô��������淴Ӧ���ʾ���������Ӧ���ʵ����淴Ӧ���ʣ�˵��ƽ�ⲻ�ƶ���ƽ��������NH3�ĺ������䣬��t3ʱ����ƽ���ƶ��������������¶ȣ�ƽ��������NH3�ĺ�����ߵ�һ��ʱ����t2��t3���ʴ�Ϊ�������¶ȣ�t2��t3��
����֪N2��ƽ��ת����Ϊ50%����������ݽ�����������ʽ��
N2��g��+3H2��g��![]() 2NH3��g��
2NH3��g��
��mol/L�� 2 4 0
�䣨mol/L�� 1 3 2
ƽ��mol/L�� 1 1 2
������ʽ�������ݿɵû�ѧƽ�ⳣ��K=![]() =
=![]() =4���ʴ�Ϊ��4��
=4���ʴ�Ϊ��4��
�ۺϳɰ���ӦΪ���������С�ķ��ȷ�Ӧ������ѹǿ��ƽ��������Ӧ�����ƶ������������������c���ϣ������¶ȣ�ƽ�����淴Ӧ�����ƶ����������������С��a���ϣ��ʴ�Ϊ��c��a��
��3����ͬ�������ͬ���ʵ���Ũ�ȵİ�ˮ������ǡ����ȫ��Ӧ�����Ȼ�泥��Ȼ������Һ��ˮ��ʹ��Һ�����ԣ�����Һ�и����ӵ����ʵ���Ũ�Ȱ����ɴ�С��˳����������Ϊc��Cl������c��NH4+����c��H+����c��OH�������ʴ�Ϊ��c��Cl������c��NH4+����c��H+����c��OH������

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ���������ó��ս��ì�ܼ�����Ҳ�����ǿ������й��뵼���ҵ���ڵ����㣬��˵�������Σ�Ϊʱδ�������ҳ����ڵIJ��㣬Ȼ����Ե�ȥ������⣬�����ð뵼���ҵ����չ׳�����������Ȼ�����(POCl3)��һ����Ҫ�Ļ���ԭ�ϣ��������뵼����Ӽ������άԭ�ϡ�һ�о�С����ʵ����ģ�ⷴӦ![]() �Ʊ�POCl3���ⶨ��Ʒ������
�Ʊ�POCl3���ⶨ��Ʒ������
���Ͽ�Ƭ��
���� | �۵㣯�� | �е㣯�� | ��Է������� | ���� |
PCl3 | -93.6 | 76.1 | 137.5 | ��ˮ����ˮ�⣬����O2��Ӧ |
POCl3 | 1.25 | 105.8 | 153.5 | ��ˮ����ˮ�⣬������PCl3 |
SOCl2 | -105 | 78.8 | 119 | ��ˮ����ˮ�⣬�����ֽ� |
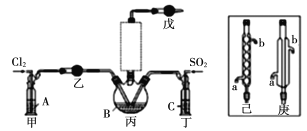
��1����ѡ��Na2SO3������70��ŨH2SO4��ȡSO2����Ӧ�Ļ�ѧ����ʽ�ǣ�____________��
��2����ҺAΪ����ʳ��ˮ����װ����Ӧ��ʢװ���Լ�Ϊ__________(����P2O5��������ʯ��������ŨH2SO4��������ˮ����ͭ��)����Ӧװ��ͼ�������δ�������������ѡ��______(����������������)��
��3���ס���װ�õ����ó�����������ľ��������⣬����________________��
��4��ˮԡ����������ƿ�����Ʒ�Ӧ�¶���60��65�棬��ԭ����___________��
��5��ͨ��������·��ɲⶨ�����ᴿ��IJ�Ʒ��POCl3�ĺ�����ȷ��ȡ1��600g��Ʒ��ˮ��ƿ��ҡ������ȫˮ�⣬��ˮ��Һ���100 mL��Һ��ȡ10��00 mL����ƿ�У�����0��2000 mol��L-1��AgNO3��Һ20��00 mL(Ag++C1- AgC1��)���ټ�������������������ʹ�������л��︲�ǡ�����NH4Fe(SO4)2��ָʾ������0��1000 mol��L-1KSCN����Һ�ζ�������AgNO3���յ�(Ag++SCN- AgSCN��)����ƽ��ʵ�飬ƽ������KSCN����Һ10��00 mL��
�ٴﵽ�ζ��յ��������____________��
��POCl3����������Ϊ___________��
����֪��KSP(AgC1)=3