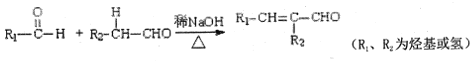题目内容
【题目】氰化钠(NaCN)是一种基本化工原料,同时也是一种剧毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。
I.(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式是____________________。
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应![]()
副反应:![]()
某化学小组利用上述原理在实验室制备过硫酸钠,并用过硫酸钠溶液处理含氰化钠的废水。
实验一:实验室通过如下图所示装置制备Na2S2O8。
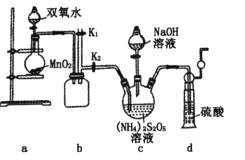
(2)装置中盛放双氧水的仪器名称是_________。
(3)装置a中反应产生的气体需要持续通入装置c的原因是______________________。
(4)上述装置中还需补充的实验仪器或装置有__________(填字母)。
A.温度计 B.洗气瓶 C.水浴加热装置 D.环形玻璃搅拌棒
实验二:测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L。
②![]() ,
,![]() ,AgI呈黄色,
,AgI呈黄色,![]() 优先与
优先与![]() 反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用
反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用![]() mol/L的标准
mol/L的标准![]() 溶液滴定,消耗
溶液滴定,消耗![]() 溶液的体积为5.00mL。
溶液的体积为5.00mL。
(5)滴定终点的现象是__________________________________。
(6)处理后的废水中氰化钠的浓度为_________mg/L;处理后的废水是否达到排放标准?___________(填“是”或“否”)。
Ⅲ.(7)常温下,含硫微粒主要存在形式,受pH影响。利用电化学原理,用惰性电极电解饱和![]() 溶液也可以制备过硫酸钠。已知在阳极放电的离子主要为
溶液也可以制备过硫酸钠。已知在阳极放电的离子主要为![]() ,则阳极反应方程式为_____________________。
,则阳极反应方程式为_____________________。
【答案】NaCN+H2O2+H2O=NH3↑+NaHCO3 分液漏斗 将产生的氨气及时排除,防止发生副反应 AC 滴入最后一滴标准硝酸银溶液,锥形瓶中溶液恰好产生黄色沉淀,且半分钟沉淀不消失 0.49 是 2HSO4--2e-=S2O82-+2H+
【解析】
(1)由题意知产生的气体为氨气,又由于产生酸式盐,由CN-分析碳元素的价态,应有碳酸氢根离子生成,据此可写出化学方程式;
(2)(3)(4)(NH4)2S2O8与氢氧化钠反应生成Na2S2O8,d装置处理尾气NH3,根据物质的制备和实验操作及注意事项分析解答;
(5)当CN-反应完全后,硝酸银试剂与指示剂碘离子反应生成黄色沉淀碘化银;
(6)根据化学计量关系Ag+~2CN-,计算废水中氰化钠的浓度,并与排放标准为0.50mg/L比较,以此判断是否达到排放标准;
(7)根据电解池阳极发生氧化反应分析。
(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,即反应生成了NaHCO3和NH3,化学方程式为NaCN+H2O2+H2O=NH3↑+NaHCO3,
故答案为:NaCN+H2O2+H2O=NH3↑+NaHCO3;
(2)由仪器构造可知,装置中盛放双氧水的仪器名称是分液漏斗,
故答案为:分液漏斗;
(3) 装置a中反应产生O2,将三颈烧瓶中产生的NH3及时排出,减少副反应的发生,
故答案为:将产生的氨气及时排除,防止发生副反应;
(4) 根据题目信息提示,可知,制备反应需要在55℃的条件下进行,90℃时发生副反应,所以需要控制温度不能超过90℃,需要水浴加热、温度计,
故答案为:AC;
(5) 用硝酸银溶液滴定过程中,当滴入最后一滴标准硝酸银溶液,溶液中出现黄色沉淀,且半分钟沉淀不消失,说明已经滴定到终点,
故答案为:滴入最后一滴标准硝酸银溶液,锥形瓶中溶液恰好产生黄色沉淀,且半分钟沉淀不消失;
(6)消耗AgNO3的物质的量为1.0×10-3L×5.00×10-3 mol·L-1=5.0×0-6mol,根据化学计量关系可知,Ag+~2CN-,处理后的10.00 mL废水中氰化钠的质量为5.0×0-6mol×2×49 g·mol-1=4.9×10-4 g,废水中氰化钠的含量为![]() =0.49mg·L-1<0.50 mg·L-1,所以处理后的废水已达到排放标准,
=0.49mg·L-1<0.50 mg·L-1,所以处理后的废水已达到排放标准,
故答案为:0.49;是;
(7)电解池阳极发生氧化反应,HSO4-失电子生成S2O82-,根据电子守恒、电荷守恒、原子守恒书写阳极反应方程式为2HSO4--2e-=S2O82-+2H+,
故答案为:2HSO4--2e-=S2O82-+2H+。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案