题目内容
4.常温下,下列有关电解质溶液中相关微粒的物质的量浓度关系不正确的是( )| A. | 0.1mol•L-1CH3COOH溶液中:c(CH3COO-)<c(H+) | |
| B. | 0.1mol•L-1NH4Cl溶液中:c(NH+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | 0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 浓度均为0.1mol•L-1NH4Cl、CH3COONH4、NH4HSO4溶液中,c(NH4+)的大小顺序:CH3COONH>NH4Cl>NH4HSO4 |
分析 A、溶液中存在醋酸和水的电离平衡;
B、溶液中存在电荷守恒分析;
C、根据混合液中的电荷守恒、物料守恒判断;
D、根据铵根离子水解的影响因素来确定.
解答 解:A、0.1mol•L-1CH3COOH溶液中存在水的电离平衡,氢离子浓度大于醋酸根离子难度:c(CH3COO-)<c(H+),故A正确;
B、0.1mol•L-1NH4Cl溶液中存在电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),故B正确;
C、0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合,则碳酸钠和碳酸氢钠的浓度相等,根据物料守恒可得:①c(CO32-)+2c(OH-)+c(HCO3-)=c(H+)+c(Na+),根据电荷守恒可得:②2c(Na+)=3c(CO32-)+3c(H2CO3)+3c(HCO3-),根据①②可得:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+),故C正确;
D、浓度均为0.1mol•L-1NH4Cl、CH3COONH4、NH4HSO4 中,电离出的铵根离子的浓度最大,CH3COONH4中铵根离子的水解受到促进,NH4HSO4中铵根离子的水解受到抑制,NH4Cl中铵根离子水解不受影响,即铵根离子的浓度大小顺序是NH4HSO4>NH4Cl>CH3COONH4,故D错误;
故选D.
点评 本题考查电解质溶液中电荷守恒和离子浓度大小比较的应用,盐的水解规律以及应用等方面的知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
13.下列各组物质中发生铝热反应的是( )
| A. | 铝粉和Fe2O3粉末 | B. | 木炭粉和CuO粉末 | C. | 铝粉和MgO粉末 | D. | 铝粉和稀盐酸 |
9.下列各组物质不能实现直接转化的是( )
| A. | SO2→H2SO4 | B. | Cu→CuCl2 | C. | Al2O3→Al(OH)3 | D. | Na→Na2O |
13.类推的思维方法在化学学习与研究中常会产生错误的结论.因此,类推出的结论最终要经过实践的检验才能决定其正确与否.以下几种类推结论中,正确的是( )
| A. | Fe3O4可以写成FeO•Fe2O3,Pb3O4也可以写成PbO•Pb2O3 | |
| B. | 不能用电解AlCl3溶液来制取金属铝,也不能用电解MgCl2溶液来制取金属镁 | |
| C. | Fe和S直接化合不能得到Fe2S3,Al和S直接化合也不能得到Al2S3 | |
| D. | FeS可以和稀硫酸反应制取硫化氢气体,CuS也可以和稀硫酸反应制取硫化氢气体 |
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
 (包括顺反异构)
(包括顺反异构)
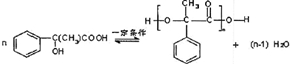
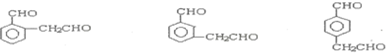 .
.