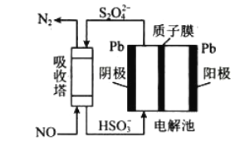
题目内容
【题目】自来水可用氯气消毒,某学生用这种自来水配制下列物质的溶液,不会产生明显药品变质问题的是( )
A. AlCl3B. FeCl2C. AgNO3D. Na2CO3
【答案】A
【解析】
自来水用氯气消毒,发生Cl2+H2O![]() H++Cl-+HClO,然后逐步分析;
H++Cl-+HClO,然后逐步分析;
自来水用氯气消毒,发生Cl2+H2O![]() H++Cl-+HClO,
H++Cl-+HClO,
A、HCl和HClO不与AlCl3发生反应,因此用自来水配制AlCl3溶液,不会产生明显药品变质,故A符合题意;
B、HClO具有强氧化性,能把Fe2+氧化成Fe3+,使FeCl2变质,故B不符合题意;
C、AgNO3与HCl反应生成AgCl沉淀,使AgNO3变质,故C不符合题意;
D、Na2CO3与HCl、HClO反应生成NaHCO3、NaCl、NaClO,使Na2CO3溶液变质,故D不符合题意。

 阅读快车系列答案
阅读快车系列答案【题目】“一碳化学”是指以研究分子中只含有一个碳原子的化合物(如CO、CO2、CH3OH等)为原料合成一系列化工产品的化学。
(一)工业上,在Cu2O/ZnO作催化剂的条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)已知:CH3OH(l)=CH3OH (g) ΔH=+35.2 kJ·mol-1,根据下表:
物质 | H2(g) | CO(g) | CH3OH(l) |
燃烧热/kJ·mol-1 | -285.8 | -283.0 | -726.5 |
反应CO(g)+2H2(g)![]() CH3OH(g)的ΔH=_____ kJ·mol-1。
CH3OH(g)的ΔH=_____ kJ·mol-1。
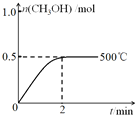
(2)向2L恒容密闭容器中通入1molCO(g)和2molH2(g),发生反应合成甲醇,反应过程中n(CH3OH)与时间(t)及温度的关系如图所示。在500℃恒压条件下,请在图中画出反应体系中n(CH3OH)与时间(t)变化总趋势图________。
(二)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应:
反应I:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1= -48.5kJ·mol-1
CH3OH(g)+H2O(g) ΔH1= -48.5kJ·mol-1
反应II:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2= +41.2kJ·mol-1
CO(g)+H2O(g) ΔH2= +41.2kJ·mol-1
(3)控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO的产率的影响如图所示:
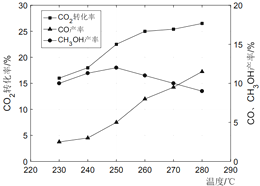
①由图可知温度升高CO产率上升,其主要原因是_____。
②由图可知获取甲醇最适宜的温度是_____。
(4)控制CO2和H2初始投料比为1:1.6,在300℃时,反应I已达到平衡状态,CO2的转化率为50%,甲醇的选择性为60%,此时容器体积为1.0L,若CO2初始加入量为2.0mol,则反应I的平衡常数是_____。
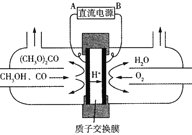
(三)以甲醇为主要原料电化学合成碳酸二甲酯[(CH3O)2CO]的反应原理如下:4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O
2(CH3O)2CO+2H2O
(5)由图可知B极为电源_____(填“正”或“负”)极,阳极电极反应式是_____。
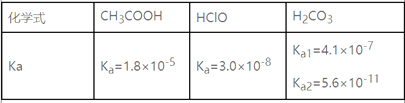
【题目】下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25 ℃)。
电解质 | 平衡方程式 | 平衡常数K | Ksp |
CH3COOH | CH3COOH | 1.76×10-5 | |
H2CO3 | H2CO3 HCO3- | K1=4.31×10-4 K2=5.61×10-11 | |
C6H5OH | C6H5OH | 1.1×10-10 | |
H3PO4 | H3PO4 H2PO4- HPO42- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
NH3·H2O | NH3·H2O | 1.76×10-5 | |
BaSO4 | BaSO4(s) | 1.0×10-10 | |
BaCO3 | BaCO3(s) | 2.5×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH,②HCO3-,③C6H5OH,④H2PO4-均可看做酸,则它们酸性最强的是_______(填编号)。
(2)向C6H5ONa溶液中通入少量CO2,写出反应的离子方程式_____________________。
(3)25 ℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)______c(NH4+)(填“>”、“=”或“<”)。
(4)25 ℃时,向10 mL 0.01 mol·L-1苯酚(C6H5OH)溶液中滴加V mL 0.01 mol·L-1氨水,混合液中粒子浓度关系正确的是________。
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度小于10 mL 0.01 mol·L-1苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
(5)Ⅰ.如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
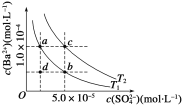
①T2温度时Ksp(BaSO4)=__________;
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是________。
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a,b之间的某一点(不含a,b)
D.升温可使溶液由b点变为d点
Ⅱ.现有0.35mol的BaSO4沉淀,每次用1 L饱和Na2CO3溶液(物质的量浓度为1.7 mol·L-1)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理________次。[提示:BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq)]
BaCO3(s)+SO42-(aq)]