题目内容
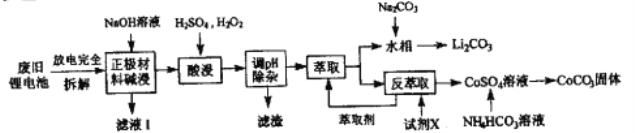
【题目】钻酸锂电池成用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑。铝箔及少量Fe,可通过下列实验方法回收钴、锂。
几种金属离子沉淀完全(离子浓度为10-5mol/L)的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
溶液pH | 3.2 | 4.7 | 9.0 | 9.2 |
回答下列问题:
(1)LiCoO2中,Co元素的化合价为_______,滤液I的主要成分是______。
(2)已知:氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2所起主要作用是______。“调节pH”除去的离子主要有Al3+和____。
(3)酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时浸出率下降的原因是________。

(4)“萃取”和“反萃取“可简单表示为: Co2++2(HA)2![]() Co(HA2)2+2H+则反萃取过程加入的试剂X是_______。
Co(HA2)2+2H+则反萃取过程加入的试剂X是_______。
(5)向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为__________。
【答案】 +3 NaAlO2、NaOH 将Co3+还原为Co2+ Fe3+ 温度升高,H2O2分解速率加快,参与酸浸反应的H2O2的量减少,导致浸出率下降 H2SO4溶液 Co2++2HCO![]() ==CoCO3↓+CO2↑+H2O
==CoCO3↓+CO2↑+H2O
【解析】(1)根据化合物中,化合价的代数和为0知,LiCoO2中,Co元素的化合价为+3价;正极中含有铝,铝易溶于强碱溶液生成NaAlO2,滤液I的主要成分是NaAlO2、NaOH;(2)已知:氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2起还原剂作用,将Co3+还原为Co2+;“调节pH”除去的离子主要有Al3+和Fe3+;(3)温度升高,H2O2分解速率加快,参与酸浸反应的H2O2的量减少,导致浸出率下降;(4)“萃取”和“反萃取“可简单表示为: Co2++2(HA)2![]() Co(HA2)2+2H+则反萃取过程加入的试剂X是一种酸溶液,结合后面产生的硫酸钴可知,X为H2SO4溶液;(5)向CoSO4溶液中加入NH4HCO3溶液得到CoCO3,则应该发生双水解,发生反应的离子方程式为Co2++2HCO
Co(HA2)2+2H+则反萃取过程加入的试剂X是一种酸溶液,结合后面产生的硫酸钴可知,X为H2SO4溶液;(5)向CoSO4溶液中加入NH4HCO3溶液得到CoCO3,则应该发生双水解,发生反应的离子方程式为Co2++2HCO![]() ==CoCO3↓+CO2↑+H2O。
==CoCO3↓+CO2↑+H2O。

【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)![]() 4NO2(g)+ O2(g) ΔH>0
4NO2(g)+ O2(g) ΔH>0
T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 100 0 | 150 0 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是
A.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1