题目内容
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果不正确的是

A. 图中,AB段的反应为Fe+2Fe3+===3Fe2+,溶液中溶质最终为硫酸亚铁
B. 原溶液中硫酸浓度为2.5 mol·L-1
C. 原混合溶液中硝酸根离子的物质的量为0.2 mol
D. 图中,OA段产生的气体是一氧化氮,BC段产生的气体是氢气
【答案】B
【解析】
A.由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑,故A正确;
B.整个过程消耗22.4gFe,最终溶质为FeSO4,根据Fe原子守恒n(FeSO4)=n(Fe)=22.4g÷56g/mol=0.4mol,根据硫酸根守恒可知n(H2SO4)=n(FeSO4)=0.4mol,每份溶液体积为100mL,所以硫酸的浓度是0.4mol÷0.1L=4mol/L,故B错误;
C.OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,所以每一份混合溶液中n(NO3-)=n(Fe)=11.2g÷56g/mol=0.2mol,故原混合溶液中NO3-为0.2mol×2=0.4mol,故C正确;
D.根据以上分析可知OA段产生的气体是NO,BC段产生的气体是氢气,故D正确。
故答案选B。

【题目】钻酸锂电池成用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑。铝箔及少量Fe,可通过下列实验方法回收钴、锂。
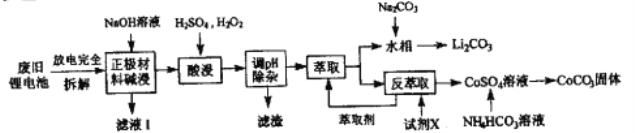
几种金属离子沉淀完全(离子浓度为10-5mol/L)的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
溶液pH | 3.2 | 4.7 | 9.0 | 9.2 |
回答下列问题:
(1)LiCoO2中,Co元素的化合价为_______,滤液I的主要成分是______。
(2)已知:氧化性Co3+>H2O2>Fe3+,“酸浸”过程中H2O2所起主要作用是______。“调节pH”除去的离子主要有Al3+和____。
(3)酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时浸出率下降的原因是________。

(4)“萃取”和“反萃取“可简单表示为: Co2++2(HA)2![]() Co(HA2)2+2H+则反萃取过程加入的试剂X是_______。
Co(HA2)2+2H+则反萃取过程加入的试剂X是_______。
(5)向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为__________。




