题目内容
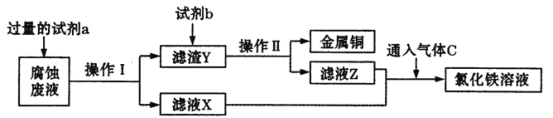
【题目】电子工业常用 30%的 FeCl3 溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)在加入①物质的过程中通常不断搅拌,搅拌的目的是_____。
(2)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的 FeCl3 溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式:①________,④____。
(3)要证明某溶液中不含 Fe3+而可能含有 Fe2+,进行如下实验操作时的最佳顺序为__________。
①加入足量氯水 ②加入足量KMnO4 溶液 ③加入少量KSCN 溶液
A.①③ B.③② C.③① D.①②③
(4)写出向②⑤的混合液中通入⑥的离子方程式:___________。
【答案】加快反应速度 Fe HCl C 2Fe2++Cl2===2Fe3++2Cl-
【解析】
通过流程图可知单质铜来自于滤渣③,则第一步为置换单质铜,故过量物质①为Fe,滤渣③为Fe和Cu的混合物,滤液②为FeCl2溶液,分开滤渣③中的Fe和Cu,又要使滤液⑤与滤液②混合,所以过量的④为稀盐酸,滤液⑤也为FeCl2溶液,②、⑤混合最终要得到FeCl3溶液,则通入⑥为过量的Cl2;
(1)在加入①物质的过程中通常不断搅拌,可加快反应速率;
(2)根据上述分析可知,①为Fe,④为稀盐酸,化学式为HCl;
(3)要证明某溶液中不存在Fe3+,而可能存在Fe2+则需先加入KSCN溶液现象溶液不变色,再通入过量的Cl2,若溶液变红则含有Fe2+,故选C;
(4)滤液②⑤为FeCl2溶液,通入氯气将Fe2+氧化为Fe3+,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-。

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目