题目内容
【题目】(1)有以下四种物质:①22g二氧化碳②8g氢气③1.204×1024个氮气分子④4℃时18mL水它们所含分子数最多的是_______,所含原子数最多的______,质量最大的是_____所含电子数最多的是__________(填序号)
(2)12.4 gNa2R含Na+0.4mol,则Na2R的摩尔质量为__________,R的相对原子质量为__________,含R的质量为1.6g的Na2R,其物质的量为_____________。
【答案】② ② ③ ③ 62 g mol-1 16 0.1 mol
【解析】
(1)①22g二氧化碳,其物质的量为![]() =0.5mol;②8g氢气,其物质的量为
=0.5mol;②8g氢气,其物质的量为![]() =4mol;③1.204×1024个氮气分子,其物质的量为
=4mol;③1.204×1024个氮气分子,其物质的量为![]() =2mol,质量为2mol×28g/mol=56g;④4℃时18mL水,其质量为18mL×1g/mL=18g,物质的量为
=2mol,质量为2mol×28g/mol=56g;④4℃时18mL水,其质量为18mL×1g/mL=18g,物质的量为![]() =1mol;故所含分子数最多的是②8g氢气;
=1mol;故所含分子数最多的是②8g氢气;
①22g二氧化碳,含有原子物质的量为0.5mol×3=1.5mol;②8g氢气,含有原子物质的量为4mol×2=8mol;③1.204×1024个氮气分子,含有原子物质的量为2mol×2=4mol;④4℃时18mL水,含有原子物质的量为1mol×3=3mol;故所含原子数最多的是 ②8g氢气;
由上述计算可知,质量最大是③1.204×1024个氮气分子;
①22g二氧化碳,含有电子物质的量为0.5mol×22=11mol;②8g氢气,含有电子物质的量为4mol×2=8mol;③1.204×1024个氮气分子,含有电子物质的量为2mol×14=28mol;④4℃时18mL水,含有原子物质的量为1mol×10=10mol;故所含电子数最多的是③1.204×1024个氮气分子;
(2)1 molNa2R中含2 molNa+,题目中有Na+ 0.4mol,则有0.2 molNa2R。运用公式M=![]() 得
得![]() =62 g mol-1。然后,根据摩尔质量以g mol-1为单位时,在数值上与物质的相对原子质量或相对分子质量相等,得:Mr(Na2R) = 62,求得Mr(R) = 62-2
=62 g mol-1。然后,根据摩尔质量以g mol-1为单位时,在数值上与物质的相对原子质量或相对分子质量相等,得:Mr(Na2R) = 62,求得Mr(R) = 62-2![]() 23=16。根据n=
23=16。根据n=![]() ,得n(R) = 0.1 mol,则n(Na2R)=0.1 mol。
,得n(R) = 0.1 mol,则n(Na2R)=0.1 mol。

 数学奥赛暑假天天练南京大学出版社系列答案
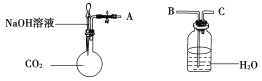
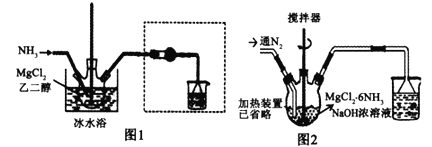
数学奥赛暑假天天练南京大学出版社系列答案【题目】已知MgCl2+6NH3![]() MgCl2·6NH3该反应具有极好的可逆吸、放氨特性。某课题组在实验室探究其特性,其中氨化(吸氨)过程实验装置如图1,放氨过程实验装置如图2。
MgCl2·6NH3该反应具有极好的可逆吸、放氨特性。某课题组在实验室探究其特性,其中氨化(吸氨)过程实验装置如图1,放氨过程实验装置如图2。
己知:相关物质的性质见下表
物质名称 | 氨气的溶解性 | 氯化镁的溶解性 | 六氨氯化镁的溶解性 |
水 | 易溶 | 易溶 | 易溶 |
甲醇(沸点65。C) | 易溶 | 易溶 | 难溶 |
乙二醇(沸点197。C) | 易溶 | 易溶 | 难溶 |
请回答:
(1)实验室采用固固加热的方式制备NH3,制备反应的方程式为___________,虚框内装置的作用是___________,氨化过程采用冰水浴的原因可能是_____(填选项序号字母)。
A.氨化过程为吸热反应,促进反应正向进行
B.加快反应速率
C.防止氨气从溶液中挥发,提高氨气利用率
D.增大六氨氯化镁的溶解度
(2)利用MgCl2溶液制备无水MgCl2,其具体操作为______________________。
(3)进行放氨实验时,三颈烧瓶加入1.97 g MgCl2·6NH3和烧碱的浓溶液,加热,并不断通入N2,通入N2目的是___________。通过观察烧杯中现象的变化就可以监控MgCl2·6NH3的放氨过程,若要判断转化率是否达到或超过90%,则烧杯中溶液可以是___________。