题目内容
【题目】用甲醇燃料电池作电源,用铁作电极电解含Cr2O72-的酸性废水,利用生成的Fe2+可将Cr2O72-转化成Cr(OH)3沉淀而除去,装置如图。下列说法正确的是
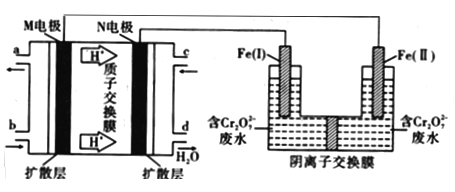
A. 由b口加入物质为O2
B. 燃料电池负极的电极反应式为CH3OH+8OH--6e-= CO32-+6H2O
C. 电解过程中,Fe(I)质量减少,Fe(Ⅱ)上有气体产生
D. 电路中每转移6mol电子,最多有1mol Cr2O72-被还原
【答案】C
【解析】试题分析:由图中质子的迁移方向可知,M为负极、N为正极,所以b口进入的是甲醇、c口进入的是氧气,Fe(I)是阳极、Fe(II)是阴极。A. 由b口加入物质为甲醇,A不正确;B. 燃料电池负极的电极反应式为CH3OH-6e -+2H2O= CO32-+8H+,B不正确;C. 电解过程中,Fe(I)是阳极,其质量减少,Fe(Ⅱ)是阴极,氢离子放电产生氢气,C正确;D. 电路中每转移6mol电子,可以生成3mol Fe2+,所以最多有0.5mol Cr2O72-被还原,D不正确。本题选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目