题目内容
【题目】物质的组成与结构决定了物质的性质与变化,回答下列问题:
(1)量子力学把电子在原子核外的一个空间运动状态称为一个____________,电子除空间运动状态外,还有一种运动状态叫做____________。
(2)硒常用作光敏材料,基态硒原子的价电子排布式为_______________;与硒同周期的p区元素中第一电离能大于硒的元素有_________种。
(3)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如下图,As原子的杂化方式为___________,雌黄和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,写出该反应方程式__________________________________________。SnCl4分子的空间构型为_________________
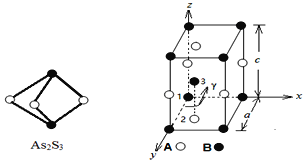
(4)某晶体的晶胞结构如上图所示,该晶体的化学式为___________,该晶胞参数为:a = 250.4 pm, c = 666.1 pm,γ = 120o;1号原子坐标为(0,0,0),2号原子坐标为(1/3,2/3,0),则3号原子坐标为_____________,计算上述晶体中A和B两原子间的最小核间距为_____________。(保留四位有效数字)
(5)体心立方堆积的晶胞是个立方体,如果半径为r的原子保持紧密接触,立方体的中心能容得下半径最大为___________的一个原子。
【答案】 原子轨道 自旋 4s24p4 3 sp3杂化 2As2S3+2 SnCl2+4HCl = As4S4 + 2 SnCl4+2H2S↑ 正四面体形 AB (1/3,2/3,1/2) 144.6 pm 0.732r或(![]() -1)r
-1)r
【解析】(1)量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,电子除空间运动状态外,还有一种运动状态叫做自旋;正确答案:原子轨道; 自旋。
(2)Se原子序数为34,电子排布式:1s22s22p63s23p63d104s24p4,基态硒原子的价电子排布式:4s24p4; 第四周期元素中第一电离能大于硒的元素有溴、砷和氪,共3 种;正确答案:. 4s24p4 ;3。
(3)雌黄分子式为As2S3,根据分子结构图可分析,As原子的杂化方式为:sp3杂化;根据反应物和生成物:As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,可以得出化学方程式为:2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑;SnCl4分子sp3杂化 ,空间构型为正四面体;正确答案:sp3杂化;2As2S3+2 SnCl2+4HCl = As4S4 + 2 SnCl4+2H2S↑; 正四面体形 。
(4)根据晶胞结构图,顶点粒子占1/8,棱上粒子占1/4,面心粒子占1/2,晶胞内部粒子为整个晶胞所有,则一个晶胞中含有A的数目为4×1/4+2×1/2=2,含有B的数目为8×1/8+1=2,则A与B的数目为1:1,所以该晶体的化学式为AB;该晶胞参数为![]() ,
,![]() ,
,![]() ,已知原子坐标1号原子坐标为(0,0,0),2号原子坐标为(1/3,2/3,0), 3号原子在2号原子之上,且在整个晶胞的中间,则3号原子其实是放在2号原子的原子坐标为(1/3,2/3,1/2);根据晶胞结构,左下角顶点A粒子与底心上面的B粒子间的距离最短,根据原子坐标,可以发现底面的A原子起始位处正三角形重心,根据立体几何知识,根据余弦定理,
,已知原子坐标1号原子坐标为(0,0,0),2号原子坐标为(1/3,2/3,0), 3号原子在2号原子之上,且在整个晶胞的中间,则3号原子其实是放在2号原子的原子坐标为(1/3,2/3,1/2);根据晶胞结构,左下角顶点A粒子与底心上面的B粒子间的距离最短,根据原子坐标,可以发现底面的A原子起始位处正三角形重心,根据立体几何知识,根据余弦定理,![]() ,可得
,可得![]() ,这是底面最长对角线的距离,A和B的距离为其1/3,即
,这是底面最长对角线的距离,A和B的距离为其1/3,即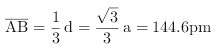 ;正确答案:AB ;(1/3,2/3,1/2); 144.6 pm 。
;正确答案:AB ;(1/3,2/3,1/2); 144.6 pm 。
(5)根据题意可知,立方体的棱长为2r,,则该立方体的面对角线为2√2r,该立方体的体对角线为:L2=(2√2r)2+(2r)2, L=2√3 r;立方体的中心能容得下半径最大的原子直径为2√3 r-2r,半径为(2√3 r-2r)/2=(![]() -1)r;正确答案0.732r或(
-1)r;正确答案0.732r或(![]() -1)r。
-1)r。