题目内容
【题目】下列化学反应的离子方程式正确的是( )
A.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合NH4++Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+Al(OH)3↓+NH3H2O
B.Na2O2加入H218O中:2Na2O2+2H218O=4Na++4OH﹣+18O2↑
C.NH4HCO3溶液与过量NaOH溶液共热:NH4++OH﹣![]() NH3↑+H2O
NH3↑+H2O
D.浓硝酸中加入过量铁粉并加热:Fe+3NO3﹣+6H+![]() Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O
【答案】A
【解析】
试题分析:A.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:,生成硫酸钡、氢氧化铝和一水合氨,离子方程式:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3H2O;故A正确;B.Na2O2加入到足量H218O中,过氧化钠既做氧化剂又做还原剂,离子方程式:2Na2O2+2H218O═4Na++418OH-+O2↑,故B错误;C.NH4HCO3溶液与过量NaOH溶液共热生成氨气和碳酸钠,故C错误;D.加入过量铁粉,生成亚铁离子,离子反应为Fe+2NO3-+4H+![]() Fe2++2NO2↑+2H2O,故D错误;故选A。
Fe2++2NO2↑+2H2O,故D错误;故选A。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案【题目】氮及其化合物在生产生活中有重要作用。
(1)已知:①氢气的燃烧热为285 kJ/mol ②N2(g) + 2O2(g) = 2NO2(g) ΔH=+133 kJ/mol。试写出H2还原NO2生成液态水和另一种无毒物质的热化学方程式_________________。
(2)一氯胺(NH2Cl)的电子式为_______________,一氯胺是重要的水消毒剂,其原因是一氯胺在水中会部分水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为______________。
(3)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
NHCl2(l)+2HCl(g),向容积均为1 L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2 mol Cl2和2 mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
t/min | 0 | 20 | 40 | 60 | 80 |
n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1. 10 | 0.80 | 0.80 |
n(Cl2) (乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应的ΔH______0(填“>”或“<”) ,乙容器中,0~40 min内用Cl2的浓度变化表示的平均反应速率v(Cl2)=_______________________。
②对该反应,下列说法不正确的是________________(填选项字母)。
A.若甲容器内气体密度不变,则表明反应达到平衡状态
B.若乙容器内Cl2和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,分离出少量产物NHCl2,有助于提高Cl2的转化率
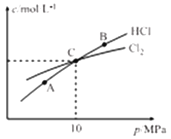
③恒温条件下,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示,则A、B、C三点中Cl2转化率最高的是_________(填“A”“B”或“C”)。