题目内容
【题目】碘是人体中不可缺少的元素,为了预防碘缺乏,通常在精盐中添加一定的KIO3。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关资料,发现其检测原理是:KIO3 + 5KI + 3H2SO4 = 3I2 + 3K2SO4 + 3H2O
(1)用双线桥表示该反应中电子转移的方向和数目___________________________________,该反应中还原产物与氧化产物的质量之比是__________,0.2mol KIO3参加反应时,转移的电子为________mol。
(2)上面实验中用到一定物质的量浓度的稀硫酸,若配制1.0 mol/L的稀硫酸500mL,配制中需要用到的主要玻璃仪器有___________(填选项),需用18.0mol/L 浓硫酸_________mL。
a.100mL量筒 b.玻璃棒 c.100mL容量瓶 d.50mL量筒 e.胶头滴管
f.烧杯 g.500mL容量瓶
(3)下面操作造成所配稀硫酸溶液浓度偏高的有____________(填选项)。
a.溶解后溶液没有冷却到室温就转移;b.转移时没有洗涤烧杯、玻璃棒;c.转移过程中有少量液体流出;d.向容量瓶加水定容时眼睛俯视液面;e.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
【答案】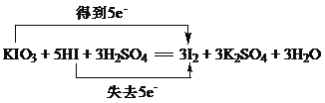 1:5 1 bdefg 27.8 ad
1:5 1 bdefg 27.8 ad
【解析】
(1)根据氧化还原反应中化合价的升降情况来标电子转移情况;碘酸钾中碘元素化合价降低是氧化剂,碘化钾中碘元素的化合价升高是还原剂;根据化合价的变化情况分析出电子的转移的物质的量;
(2)利用稀释定律C浓V浓=C稀V稀来计算;根据配制一定物质的量浓度的溶液的步骤是:计算、量取、稀释、移液、洗涤、定容、摇匀来选择使用的仪器;
(3)根据C=n÷V,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差。
(1)氧化还原反应KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,化合价升高值=化合价降低值=转移电子数=5,电子转移情况如下: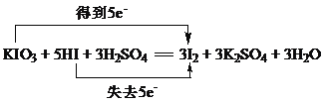 ;
;
KI为还原剂,+5价的I元素被还原,还原产物与氧化产物均为碘,由原子守恒及反应可知,物质的量之比为1:5;
根据反应方程式得1mol KIO3参加反应 时转移电子5mol,则0.2mol KIO3参加反应时转移电子0.2×5mol=1mol。
(2)设浓硫酸的体积为VmL,稀释前后溶质物质的量不变,则:1 mol·L-1×0.5L=18mol·L-1×V×10-3L,解得V=27.8mL;配制中需要用到的主要玻璃仪器是b.玻璃棒 d.50mL量筒 e.胶头滴管f.烧杯 g.500mL容量瓶,故选bdefg ;
(3)
a.未冷却到室温就将溶液转移到容量瓶并定容,溶液冷却后体积偏小,配制的溶液浓度偏高,故a正确;
b.转移时没有洗涤烧杯、玻璃棒,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故b错误;
c.转移过程中有少量液体流出,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故c错误;
d.向容量瓶加水定容时眼睛俯视液面,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,溶液浓度偏高,故d正确;
e.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线,配制的溶液体积偏大,溶液浓度偏小,故e错误。
故选 ad。

【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
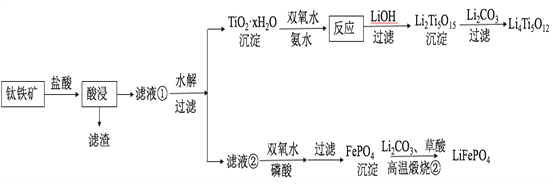
回答下列问题:
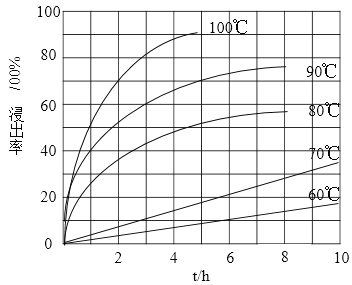
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。