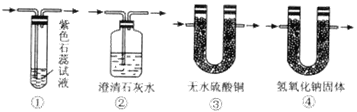
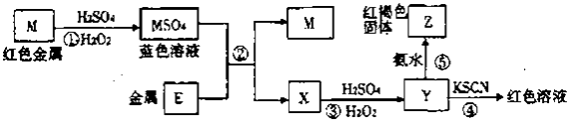
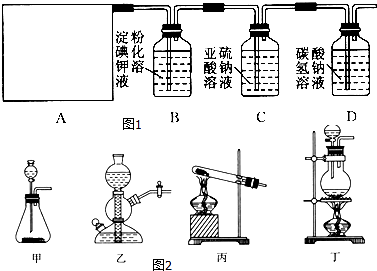
��Ŀ����
����Ŀ����֪��H2��g��+I2��g��2HI��g����H=��14.9kJ/mol��ij�¶����ڼס������������ܱ������г��뷴Ӧ�����ʼŨ�����±���ʾ�����з�Ӧ�ﵽƽ��ʱ�����c��H2��=0.008mol/L�� �����ж���ȷ�ģ� ��
��ʼŨ�� | c��H2��/mol/L | c��I2��/mol/L | c��HI��/mol/L |
�� | 0.01 | 0.01 | 0 |
�� | 0.02 | 0.02 | 0 |
A.ƽ��ʱ������H2��ת�����Ǽ��е�2��
B.ƽ��ʱ�����л�������ɫ��������
C.ƽ��ʱ���ס����������ı仯ֵ���
D.���¶��£���Ӧ��ƽ�ⳣ��K=0.25
���𰸡�D
���������⣺A���÷�Ӧǰ�������������䣬���е�Ũ��Ϊ���е�2��������ѹǿΪ����2����ѹǿ��Ӱ��ƽ���ƶ�������Ϊ��Чƽ�⣬ƽ��ʱ��Ӧ����ֵ�ת������ͬ����A����B������Ϊ��Чƽ�⣬ƽ��ʱ����c��I2���Ǽ��е�2����ƽ��ʱ������ɫ�����B����
C������Ϊ��Чƽ�⣬��Ӧ��ת������ͬ�����вμӷ�ӦI2���Ǽ��е�2�������е������仯�Ǽ��е�2������C����
D��ƽ��ʱ������Ũ��Ϊ0.008mol/L����
H2��g��+I2��g��2HI��g����
��ʼ��mol/L����0.01 0.010
�仯��mol/L����0.002 0.0020.004
ƽ�⣨mol/L����0.008 0.0080.004
�ʸ��¶��¸÷�Ӧ��ƽ�ⳣ��k= ![]() =0.25����D��ȷ��
=0.25����D��ȷ��
��ѡD��
�����㾫�������û�ѧƽ�ⳣ���ĺ���ͻ�ѧƽ��״̬���ʼ���������Ŀ�����жϼ��ɵõ��𰸣���Ҫ��ָ֪��һ�������µĿ��淴Ӧ�����Ӧ���淴Ӧ��������ȣ���Ӧ������и���ֵ�Ũ�Ȳ����״̬����ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�