题目内容
【题目】某中学化学兴趣小组学生在学习“含硫化合物的性质和应用”时,进行了如下实验探究:为了验证浓硫酸和碳在加热的情况下反应的生成物,用图Ⅰ装置进行实验。

(1)请写出碳与浓硫酸反应的化学反应方程式_________________________________;该反应中氧化剂与还原剂的物质的量之比为_____________;
(2)图Ⅰ中A处是完成实验中的必要装置,它是下图所示中的_________;(填编号)
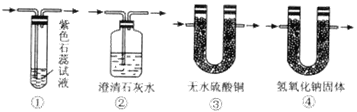
(3)图Ⅰ中C装置中应盛的试剂最好为:足够的_______________,其作用是__________________;
(4)若出现_______________________ 的实验现象,则可以确定存在二氧化碳气体。
(5)现实验小组的同学继续进行实验,他们将二氧化硫和氯气按一定的比例同时通入品红溶液中,一段时间后,发现品红溶液没有褪色。试分析实验过程中,品红不褪色的原因___________________(用离子反应方程式表示);你认为怎么样做可以让品红的颜色越来越浅?_________________。
【答案】 C+2H2SO4(浓) = 2SO2↑+CO2↑+2H2O 2:1 ③ KMnO4溶液 除去混合气体中的二氧化硫 C中高锰酸钾不褪色,D中澄清石灰水变浑浊 2H2O+SO2+Cl2 = 2Cl-+SO42-+4H+ 二氧化硫与氯气不以1:1通入
【解析】(1)浓硫酸有氧化性,加热时氧化性更强,木炭粉有还原性,两者相互反应,浓硫酸被还原成SO2,木炭粉则被氧化成CO2,反应生成SO2、CO2和H2O,反应的化学方程式是C+2H2SO4(浓) = 2SO2↑+CO2↑+2H2O;根据反应方程式可知,氧化剂H2SO4和还原剂的物质的量之比为2:1;(2)检验水蒸气的试剂是无水硫酸铜;若在通过水溶液后再检验则无法检验水是否是生成物,图Ⅰ中A处是完成水检验的实验,必要装置选③;(3)图Ⅰ中C装置是除去二氧化硫且检验二氧化硫已除尽,应盛的试剂最好为:足够的KMnO4溶液,其作用是除去混合气体中的二氧化硫;(4)若出现C中高锰酸钾不褪色,D中澄清石灰水变浑浊的实验现象,则可以确定存在二氧化碳气体;(5)若将二氧化硫和氯气按1:1同时通入品红溶液中,发生反应2H2O+SO2+Cl2 = 2Cl-+SO42-+4H+,则品红不褪色;若二氧化硫与氯气不以1:1通入,发生反应2H2O+SO2+Cl2 = 2Cl-+SO42-+4H+后剩余的SO2或Cl2均能使品红溶液褪色而颜色越来越浅。

【题目】已知:H2(g)+I2(g)2HI(g)△H=﹣14.9kJ/mol.某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示.甲中反应达到平衡时,测得c(H2)=0.008mol/L. 下列判断正确的( )
起始浓度 | c(H2)/mol/L | c(I2)/mol/L | c(HI)/mol/L |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25