题目内容
【题目】根据下列框图分析.下列说法正确的是( ) 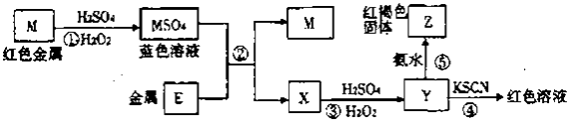
A.E2+的氧化性比M2+的氧化性弱
B.在反应①中硫酸既表现了酸性、又表现了氧化性
C.反应④的离子方程式可表示为:3SCN﹣+E3+=E(SCN)3↓
D.在③反应中若不加稀硫酸可能看到红褐色沉淀
【答案】D
【解析】解:流程分析可知,M为铜,在酸性溶液中被过氧化氢氧化为铜盐溶液CuSO4 , 依据y加入KSCN溶液血红色说明是Fe3+离子,和氨水反应生成红褐色沉淀氢氧化铁;说明X为亚铁离子形成的硫酸亚铁溶液,推断E为Fe;A、依据阳离子氧化性强弱,结合金属活动顺序表分析判断;Fe2+的氧化性比Cu2+的氧化性弱,故A正确;
B、反应①中硫酸只是提供酸性环境,过氧化氢做氧化剂氧化铜,故B错误;
C、反应④的离子方程式可表示为:3SCN﹣+Fe3+=Fe(SCN)3;生成的是血红色溶液,不是沉淀,故C错误;
D、在③反应中若不加稀硫酸,硫酸亚铁被过氧化氢氧化为硫酸铁,在中性溶液中 铁离子会沉淀,可能看到红褐色沉淀,故D正确;
故选D.

练习册系列答案
相关题目
【题目】已知:H2(g)+I2(g)2HI(g)△H=﹣14.9kJ/mol.某温度下在甲、乙两个恒容密闭容器中充入反应物,其起始浓度如下表所示.甲中反应达到平衡时,测得c(H2)=0.008mol/L. 下列判断正确的( )
起始浓度 | c(H2)/mol/L | c(I2)/mol/L | c(HI)/mol/L |
甲 | 0.01 | 0.01 | 0 |
乙 | 0.02 | 0.02 | 0 |
A.平衡时,乙中H2的转化率是甲中的2倍
B.平衡时,甲中混合物的颜色比乙中深
C.平衡时,甲、乙中热量的变化值相等
D.该温度下,反应的平衡常数K=0.25