题目内容
2.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法
该法的工艺流程为:CrO${\;}_{4}^{2-}$$→_{①转化}^{H+}$Cr2O${\;}_{7}^{2-}$$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{OH-}$Cr(OH)3↓
其中第①步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(1)若该平衡处于强酸性环境中,则溶液显橙色.
(2)能说明第①步反应达平衡状态的是C.
a.Cr2O72-和CrO42-的浓度相同 b.2v(Cr2O72-)=v(CrO42-) c.溶液的颜色不变
(3)写出第②步中反应的离子方程式Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O.
方法2:电解法
该法用Fe做阳极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(4)用Fe做电极的原因为Fe-2e-=Fe2+,Fe2+做还原剂.
(5)在阴极附近溶液pH升高的原因是(用电极反应式解释)2H++2e-=H2↑.溶液中同时生成的沉淀还有Fe(OH)3.
分析 (1)根据外界条件对平衡的影响来确定平衡移动方向,从而确定离子浓度大小和溶液颜色变化;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡;
(3)根据氧化还原反应确定生成物并配平,所以离子反应方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(4)用Fe做电极进行电解,阳极发生Fe-2e-=Fe2+,生成的亚铁离子与Cr2O72-发生氧化还原反应被还原为Cr3+然后生成Cr(OH)3沉淀除去;
(5)阴极氢离子得电子生成氢气,所以溶液pH升高,同时生成铁离子也转化为氢氧化铁沉淀.
解答 解:(1)c(H+)增大,平衡2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙;
(2)平衡时各物质的浓度不再改变,即溶液的颜色不再改变,故选:C;
(3)第②步中反应的离子方程式:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(4)用Fe做电极进行电解,阳极发生Fe-2e-=Fe2+,生成的亚铁离子与Cr2O72-发生氧化还原反应被还原为Cr3+然后生成Cr(OH)3沉淀除去,故答案为:Fe-2e-=Fe2+,Fe2+做还原剂;
(5)阴极氢离子得电子生成氢气,电极反应式为:2H++2e-=H2↑,同时生成铁离子也转化为氢氧化铁沉淀,故答案为:2H++2e-=H2↑;Fe(OH)3.
点评 本题主要考查了化学平衡移动原理、氧化还原反应、沉淀溶解平衡等内容.解题根据题给信息,再结合相关原理可进行解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:下列说法正确的是( )
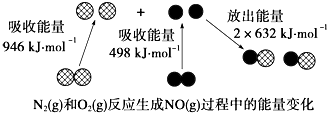

| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
10.下列实验方法,能达到目的是( )
| A. | 用托盘天平称量25.20 g氯化钠固体 | |
| B. | 将干燥的氯气依次通过干燥红色布条和湿润红色布条检验氯气能否与水发生反应 | |
| C. | 用饱和溶液FeCl3和NaOH溶液混合制备Fe(0H)3胶体 | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
17.已知分解1molH2O2放出热量98kJ.在含有少量I-的溶液中,H2O2分解的机理为:
H2O2+I-→H2O+IO-
H2O2+IO-→H2O+O2+I-.
下列有关该反应的说法不正确的是( )
H2O2+I-→H2O+IO-
H2O2+IO-→H2O+O2+I-.
下列有关该反应的说法不正确的是( )
| A. | H2O2(l)═2H2O(g)+O2(g)△H=-196kJ•mol-1 | |
| B. | 在该反应中H2O2既做氧化剂.又做还原剂 | |
| C. | 反应速率与I-浓度有关 | |
| D. | v(H2O2)=v(H2O)=v(O2) |
7.100℃时,将0.1mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)?2NO2 (g).下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
| A. | N2O4的消耗速率与NO2的生成速率之比为1:2 | |
| B. | 烧瓶内气体的颜色不再加深 | |
| C. | 烧瓶内气体的平均相对分子质量不再变化 | |
| D. | 烧瓶内气体的压强不再变化 |
14.化学与生活密切相关,下列说法不正确的是( )
| A. | 乙烯可作水果的催熟剂 | B. | 硅胶可作袋装食品的干燥剂 | ||
| C. | 二氧化硫可作食品的漂白剂 | D. | 氢氧化铝可作胃酸的中和剂 |
11.下列说法正确的是( )
| A. | 可食用植物油含有的高级脂肪酸甘油酯是人体的营养物质 | |
| B. | 石油的分馏、煤的液化和气化都是物理变化,石油的裂化、裂解都是化学变化 | |
| C. | 淀粉、蛋白质、葡萄糖都是高分子化合物 | |
| D. | 以重油为原料裂解得到各种轻质油 |
12.下列物质属于天然高分子化合物的是( )
| A. | 天然气 | B. | 葡萄糖 | C. | 聚乙烯 | D. | 蛋白质 |
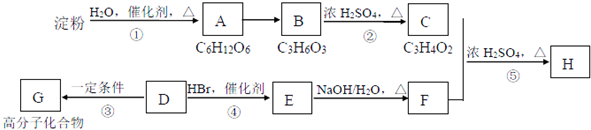
 ;反应类型:加聚反应.反应④的化学方程式:CH3CH=CH2+HBr$\stackrel{催化剂}{→}$CH3CHBrCH3;反应类型:加成反应.
;反应类型:加聚反应.反应④的化学方程式:CH3CH=CH2+HBr$\stackrel{催化剂}{→}$CH3CHBrCH3;反应类型:加成反应.