题目内容
12.(1)现有34g某气体,它的摩尔质量为17g•mol-1.则:①该气体的物质的量为2mol.
②该气体所含分子数为2NA.
③该气体在标准状况下的体积为44.8L.
④该气体完全溶解于50mL水后稀释得2L溶液,物质的量浓度1mol•L-1.
(2)将100mL 0.5mol•L-1 Na2CO3溶液加水稀释到1000mL,稀释后c(Na+)=0.1mol•L-1.
(3)36g H2O中的氧原子数目与标准状况下22.4L CO2中的氧原子数目相同.
分析 (1)根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$=cV计算;
(2)稀释前后溶质的物质的量不变,然后根据c=$\frac{n}{V}$来求解;
(3)根据氧原子数目相等列出2H2O~~~CO2关系式.
解答 解:解:(1)①n=$\frac{34g}{17g/mol}$=2mol,故答案为:2;
②N=nNA=2NA,故答案为:2;
③V=nVm=2mol×22.4L/mol=44.8L,故答案为:44.8;
④c=$\frac{2mol}{2L}$=1mol/L,故答案为:1;
(2)稀释前后溶质的物质的量不变,然后根据c=$\frac{n}{V}$=$\frac{0.1L×0.5mol/L×2}{1L}$=0.1mol/L,故答案为:0.1;
(3)由2H2O~~~CO2关系式,也就是36g的水与标准状况下22.4L CO2中的氧原子数目相同,故答案为:36.
点评 本题考查物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意相关计算公式的运用,难度不大.

练习册系列答案
相关题目
2.已知某芳香族化合物A,其分子式为C7H6O2,又知A在一定条件下能与新制氢氧化铜悬浊液反应,则符合上述条件的A有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
3.在标况下,下列物质中,与0.3moLH2O含相同氢原子数的物质是( )
| A. | 0.6mol H2SO4 | B. | 3.612×1023个HNO3分子 | ||
| C. | 7.3g HCl | D. | 4.48L CH4 |
20.下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
| A. | 合成氨工厂通常采用20 MPa~50 MPa压强,以提高原料的利用率 | |
| B. | 合成氨工业中使反应温度达到500℃有利于氨的合成 | |
| C. | 合成三氧化硫过程中使用过量的氧气,以提高二氧化硫的转化率 | |
| D. | 阴暗处密封有利于氯水的储存 |
7.100℃时,将0.1mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)?2NO2 (g).下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
| A. | N2O4的消耗速率与NO2的生成速率之比为1:2 | |
| B. | 烧瓶内气体的颜色不再加深 | |
| C. | 烧瓶内气体的平均相对分子质量不再变化 | |
| D. | 烧瓶内气体的压强不再变化 |
17.关于12C18O 和14N2两种气体,下列说法正确的是( )
| A. | 若体积相等,则密度相等 | B. | 若质量相等,则质子数相等 | ||
| C. | 若分子数相等,则体积相等 | D. | 若原子数相等,则电子数相等 |
4.下列反应不是氧化还原反应的是( )
| A. | 2Cu+O2═2 CuO | B. | CaO+H2O═Ca(OH)2 | ||
| C. | 2KMnO4═K2MnO4+MnO2+O2↑ | D. | 2Na+2H2O═2NaOH+H2↑ |
1.某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl 3种固体原料按物质的量之比为2:1:2溶于水,但实验室只有KCl和(NH4)2SO4固体,应取KCl和(NH4)2SO4固体的物质的量之比为多少配成的营养液也可以满足上述要求( )
| A. | 2:1 | B. | 1:1 | C. | 4:1 | D. | 3:2 |
2.烷烃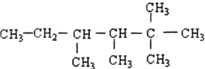 是由某单烯烃与H2加成后的产物,不考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )
是由某单烯烃与H2加成后的产物,不考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )
 是由某单烯烃与H2加成后的产物,不考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )
是由某单烯烃与H2加成后的产物,不考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |