题目内容
【题目】过二硫酸钾(K2S2O8)在科研与工业上有重要用途。
(1)S2O82-的结构式为[![]() ]2-,其中S元素的化合价为_____。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是_____(填离子符号)。
]2-,其中S元素的化合价为_____。在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是_____(填离子符号)。
(2)某厂采用湿法K2S2O8氧化脱硝和氨法脱硫工艺综合处理燃煤锅炉烟气,提高了烟气处理效率,处理液还可以作为城市植被绿化的肥料。
①脱硫过程中,当吸收液pH=6时,n(SO32-)﹕n(HSO3-)=____。[已知:25℃时,Ka1(H2SO3)=1.5×10-2;Ka2(H2SO3)=1.0×10-7]
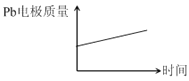
②脱硝过程中依次发生两步反应:第1步K2S2O8将NO氧化成HNO2,第2步K2S2O8继续氧化HNO2,第2步反应的化学方程式为________________________________;一定条件下,NO去除率随温度变化的关系如图所示。80℃时,若NO初始浓度为450 mg·m-3,t min达到最大去除率,NO去除的平均反应速率:v(NO) =_______mol.L-1·min-1(列代数式)。
(3)过二硫酸钾可通过“电解→转化→提纯”方法制得,电解装置如下图所示。
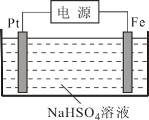
①电解时,铁电极连接电源的______极。
②常温下,电解液中含硫微粒主要存在形式与pH的关系如下图所示。已知,硫酸的二级电离常数1.02×10-2,在阳极放电的离子主要是HSO4-,阳极区电解质溶液的pH范围为________,阳极的电极反应式为________。
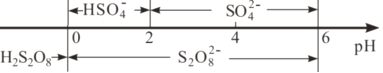
③往电解产品中加入硫酸钾,使其转化为过二硫酸钾粗产品,提纯粗产品的方法是____________。
【答案】+6 MnO4- 1:10 HNO2+ K2S2O8+ H2O = HNO3 + K2SO4+ H2SO4 15×0.916×10-6/t(或13.74×10-6/t或450÷30×0.916×10-6/t) 负 [0,2] 2HSO4-–2e-= S2O82-+2H+ 重结晶
【解析】
(1)根据S2O82-的结构式判断S的化合价,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是MnO4-;
(2)①根据pH=6时,Ka2=c(SO32-)c(H+)/c(HSO3-)=1.0×10-7,计算n(SO32-)∶n(HSO3-)的比值;
②根据第2步,K2S2O8继续氧化HNO2,K2S2O8作氧化剂,还原成H2SO4写出化学方程式,根据速率的公式进行计算;
(3)①电解时,铁作阴极,铁电极连接电源的负极;
②阳极区电解质溶液的pH范围为0-2,根据S化合价不变,O由-2升高至-1价,失电子,写出阳极的电极反应式;
③依据两者的溶解度差异,提纯粗产品的方法用重结晶的方法。
(1)S2O82-的结构式为![]() ,每个硫与4个O原子形成6个共价键,其中S元素的化合价为+6;在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是MnO4-,故答案为:+6,MnO4-。
,每个硫与4个O原子形成6个共价键,其中S元素的化合价为+6;在Ag+催化下,S2O82-能使含Mn2+的溶液变成紫红色,氧化产物是MnO4-,故答案为:+6,MnO4-。
(2)①脱硫过程中,当氨吸收液的pH=6时,HSO3-SO32-+H+,Ka2=c(SO32-)c(H+)/c(HSO3-)=1.0×10-7,n(SO32-)∶n(HSO3-)=1:10,故答案为:1:10。
②脱硝过程中依次发生两步反应:第1步,K2S2O8将NO氧化成HNO2,第2步,K2S2O8继续氧化HNO2,K2S2O8作氧化剂,还原成H2SO4,第2步反应的化学方程式为HNO2+K2S2O8+H2O=HNO3+K2SO4+H2SO4;80℃时,若NO初始浓度为450mg·m-3,即450/30×10-6mol/L,tmin达到最大去除率为0.916,NO去除的平均反应速率:v(NO)= 450÷30×0.916×10-6/tmol·L-1·min-1,故答案为:HNO2+K2S2O8+H2O=HNO3+K2SO4+H2SO4;15×0.916×10-6/t(或13.74×10-6/t或450÷30×0.916×10-6/t)。
(3)①电解时,铁作阴极,铁电极连接电源的负极,故答案为:负极。
②常温下,在阳极放电的离子主要是HSO4-,电解HSO4-生成S2O82-,由图HSO4-存在的pH范围-2~2,S2O82-存在的pH范围0-2,阳极区电解质溶液的pH范围为0-2;S化合价不变,O由-2升高至-1价,失电子,阳极的电极反应式为2HSO4-–2e-=S2O82-+2H+;
故答案为:[0,2];2HSO4-–2e-=S2O82-+2H+。
③往电解产品中加入硫酸钾,使其转化为过二硫酸钾粗产品,依据两者的溶解度差异,提纯粗产品的方法用重结晶的方法,故答案为:重结晶。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】一定量的Na、Mg、Al分别与足量的盐酸反应,放出的氢气在相同条件下体积比为1:2:3,则Na、Mg、Al三种金属的物质的量之比为( )
A.1:1:1B.1:2:3C.1:1:2D.3:3:4
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. AB. BC. CD. D