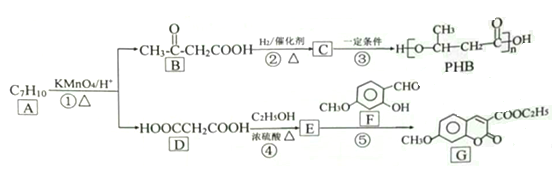
题目内容
【题目】回答下列问题。
(1)CS2是一种常用的溶剂,CS2的分子中存在________个σ键。在H—S、H—Cl两种共价键中,键的极性较强的是______,键长较长的是_____。
(2)氢的氧化物与碳的氧化物中,分子极性较小的是________(填分子式)。
(3)醋酸的球棍模型如图1所示。
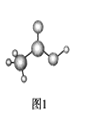
①在醋酸中,碳原子的轨道杂化类型有________;
②Cu的水合醋酸盐晶体局部结构如图2所示,该晶体中含有的化学键是________(填选项字母)。
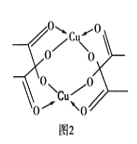
A.极性键 B.非极性键 C.配位键 D.金属键
【答案】2 H—Cl l H—S CO2 sp3、sp2 A、B、C
【解析】
(1)CS2的结构与CO2的相似,均为直线型结构,其结构简式为:S=C=S,因为一个双键由一个σ键和一个Π键组成,所以CS2的分子中存在2个σ键;因为Cl的非金属性比S的强,所以在H—S、H—Cl两种共价键中,键的极性较强的是H—Cl,因而其键长较短,所以H—S的键长较长;
(2)氢的氧化物为H2O,碳的氧化物为CO2,H2O是V形结构,CO2是直线形结构,因此分子极性较小的是CO2;
(3)①在醋酸分子中,甲基上C原子的杂化轨道类型是sp3杂化,羧基上的C原子是sp2杂化;
②根据Cu的水合醋酸盐晶体局部结构可知,该晶体中含有的化学键有碳氧之间的极性键,碳原子与碳原子之间的非极性键以及氧原子与铜原子之间的配位键,答案选ABC。

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目