题目内容
17.NA表示阿伏加德罗常数,则下列说法正确的是( )| A. | 标准状况下,11.2 L H2O所含的电子数为5NA | |
| B. | 0.1molFe原子变成 Fe3+时失去的电子数为O.3NA | |
| C. | 常温常压下,16gO2与16gO3含有的分子数为相同 | |
| D. | 0.1mol/LK2SO4溶液中含有K+数目为0.2NA |
分析 A、标况下水为液体;
B、根据铁的价态变化来分析;
C、氧气和臭氧的摩尔质量分别为32g/mol和48g/mol;
D、溶液体积不明确.
解答 解:A、标况下水为液体,故不能根据气体摩尔体积来计算其物质的量和电子数,故A错误;
B、根据铁的价态由0价变为+3价可知,1mol铁失去3mol电子,则0.1mol铁失去0.3mol电子即0.3NA个,故B正确;
C、氧气和臭氧的摩尔质量分别为32g/mol和48g/mol,故16g氧气的物质的量为n=$\frac{16g}{32g/mol}$=0.5mol,而16g臭氧的物质的量n=$\frac{16g}{48g/mol}=\frac{1}{3}mol$,故两者的分子个数之比为3:2,故C错误;
D、溶液体积不明确,故溶液中的钾离子的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
7.苯甲酸广泛应用于制药和化工行业,用甲苯制备苯甲酸的反应原理如下:
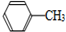 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$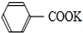 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
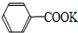 +HCl→
+HCl→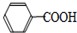 +KCl
+KCl
甲苯和KMnO4溶液在100℃反应一段时间后停止反应,分离出苯甲酸和回收未反应的甲苯流程如下

已知:苯甲酸熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;下列说法正确的是( )
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$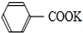 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O +HCl→
+HCl→ +KCl
+KCl甲苯和KMnO4溶液在100℃反应一段时间后停止反应,分离出苯甲酸和回收未反应的甲苯流程如下

已知:苯甲酸熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;下列说法正确的是( )
| A. | 上述反应原理的两个反应都是氧化还原反应 | |
| B. | 操作Ⅰ是蒸馏,操作Ⅱ是分液 | |
| C. | 无色液体A是甲苯,白色固体B主要成分是苯甲酸 | |
| D. | 无色液体A是苯甲酸,白色固体B主要成分是甲苯 |
8.下列有关物质的鉴别方法正确的是( )
| A. | 在进行焰色反应时,透过蓝色钴玻璃看到紫色火焰,证明含K+,不含Na+ | |
| B. | 向某无色溶液中加入稀盐酸无现象,再加入BaCl2溶液产生白色沉淀,证明含SO42ˉ | |
| C. | 向某无色溶液中加入稀盐酸后,再加入AgNO3溶液,产生白色沉淀,证明含Clˉ | |
| D. | 向某无色溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体,证明含CO32ˉ |
12.在同温同压下,某有机物和过量Na反应得到15mL氢气,另取一份等质量的该有机物和足量的NaHCO3反应得20mL二氧化碳;则该有机物可能是( )
| A. | HOOC-COOH | B. | HOCH2CH(OH)COOH | C. | HOOCCH(OH)CH2COOH | D. | CH2OHCH2OH |
2.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 标准状况下,2.24 L Cl2与足量的稀NaOH溶液反应,转移电子总数为0.2NA | |
| B. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| C. | 欲配制1.00 L 1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| D. | 标准状况下,0.1NA的SO3的体积约为2.24 L |
9.CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol
反应过程中测定的部分数据如下表:
(1)反应0~2min末的平均速率v(COCl2)=0.1mol/(L?min).
(2)在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
(3)在表格中画出0~4min末n(COCl2)随时间的变化示意图图2
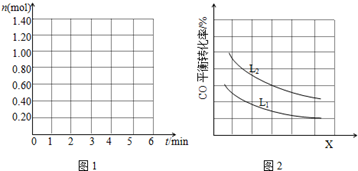
(4)已知X、L可分别代表温度或压强,如图2表示L一定时,CO的转化率随X的变化关系.X代表的物理量是温度;a<0 (填“>”,“=”,“<”),依据是因为X增大时,CO的平衡转化率降低,平衡逆向移动.
反应过程中测定的部分数据如下表:
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
(2)在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
(3)在表格中画出0~4min末n(COCl2)随时间的变化示意图图2

(4)已知X、L可分别代表温度或压强,如图2表示L一定时,CO的转化率随X的变化关系.X代表的物理量是温度;a<0 (填“>”,“=”,“<”),依据是因为X增大时,CO的平衡转化率降低,平衡逆向移动.
6.下列有关热化学方程式的叙述正确的是( )
| A. | 已知S(单斜,s)=S(正交,s)△H<0,则单斜硫比正交硫稳定 | |
| B. | HCl和NaOH反应的中加热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| C. | 已知S(g)+O2(g)═SO2(g)△H1<0;S(s)+O2(g)═SO2(g)△H2<0 则△H1<△H2 | |
| D. | 下列反应中,反应物的总能量E1与生成物的总能量E2一定相等$\stackrel{A+B}{反应物总能量{E}_{1}}$$\stackrel{发生反应A+B=C+D}{→}$$\stackrel{C+D}{生成物总能量{E}_{2}}$ |
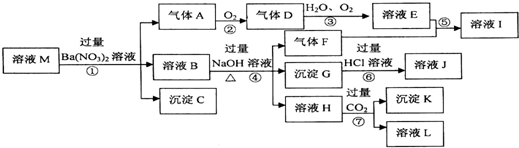
 ,沉淀C的化学式为:BaSO4,沉淀G的化学式为:Fe(OH)3.
,沉淀C的化学式为:BaSO4,沉淀G的化学式为:Fe(OH)3.