题目内容
14.相同条件下,有质量相等的CO和CO2,下列有关叙述正确的是( )①它们所占的体积之比为7:11
②它们所含的氧原子数目之比为11:14
③它们所含的原子总数目之比为22:21
④它们的密度之比为7:11
⑤它们所含的电子总数之比为7:11.
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ①②②③④⑤ |
分析 由n=$\frac{m}{M}$可知,相同条件下,质量相等的CO和CO2的物质的量之比为 44g/mol:28g/mol=11:7,分子数目之比为11:7.
①相同条件下,气体体积之比等于其物质的量之比;
②CO分子含有1个O原子、CO2分子含有2个O原子;
③CO分子含有2个原子、CO2分子含有3个原子;
④相同条件下,气体密度之比等于其摩尔质量之比;
⑤CO分子含有14个电子、CO2分子含有22个电子.
解答 解:由n=$\frac{m}{M}$可知,相同条件下,质量相等的CO和CO2的物质的量之比为 44g/mol:28g/mol=11:7,分子数目之比为11:7.
①相同条件下,气体体积之比等于其物质的量之比,则二者体积之比为11:7,故①错误;
②CO分子含有1个O原子、CO2分子含有2个O原子,二者含有氧原子数目之比为11×1:7×2=11:14,故②正确;
③CO分子含有2个原子、CO2分子含有3个原子,二者含有原子数目之比为11×2:7×3=22:21,故③正确;
④相同条件下,气体密度之比等于其摩尔质量之比,二者密度之比为28g/mol:44g/mol=7:11,故④正确;
⑤CO分子含有14个电子、CO2分子含有22个电子,二者含有电子数目之比为11×14:7×22=1:1,故⑤错误,
故选:B.
点评 本题考查物质的量计算、阿伏伽德罗定律及其推论,难度不大,注意对基础知识的巩固.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
4.草酸钴用途广泛,可用于指示剂和催化剂的制备.一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如图1:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原(填离子符号).
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取
剂适宜的pH是B.
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价.该反应的离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O.
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是除去溶液中的Mn2+;使用萃取
剂适宜的pH是B.
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=0.7.
2.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 标准状况下,2.24 L Cl2与足量的稀NaOH溶液反应,转移电子总数为0.2NA | |
| B. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| C. | 欲配制1.00 L 1.00 mol•L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 | |
| D. | 标准状况下,0.1NA的SO3的体积约为2.24 L |
9.CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol
反应过程中测定的部分数据如下表:
(1)反应0~2min末的平均速率v(COCl2)=0.1mol/(L?min).
(2)在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
(3)在表格中画出0~4min末n(COCl2)随时间的变化示意图图2
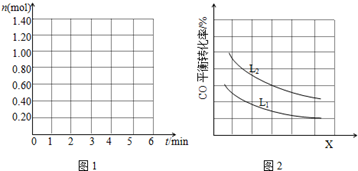
(4)已知X、L可分别代表温度或压强,如图2表示L一定时,CO的转化率随X的变化关系.X代表的物理量是温度;a<0 (填“>”,“=”,“<”),依据是因为X增大时,CO的平衡转化率降低,平衡逆向移动.
反应过程中测定的部分数据如下表:
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
(2)在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5.
(3)在表格中画出0~4min末n(COCl2)随时间的变化示意图图2

(4)已知X、L可分别代表温度或压强,如图2表示L一定时,CO的转化率随X的变化关系.X代表的物理量是温度;a<0 (填“>”,“=”,“<”),依据是因为X增大时,CO的平衡转化率降低,平衡逆向移动.
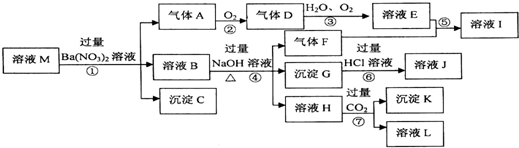
 ,沉淀C的化学式为:BaSO4,沉淀G的化学式为:Fe(OH)3.
,沉淀C的化学式为:BaSO4,沉淀G的化学式为:Fe(OH)3.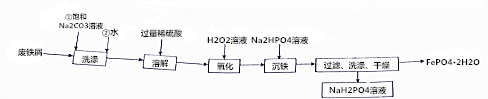
 ;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.
;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.