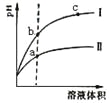
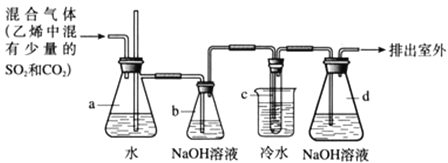
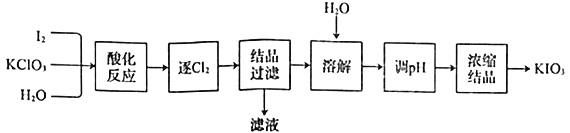
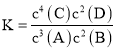题目内容
【题目】一种光化学电池的结构如图所示,电池总反应为AgCl(s)+ Cu+(aq) = Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中不正确的是
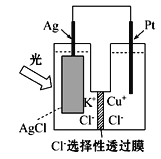
A.电子的运动方向:Pt→外电路→Ag→内电路→PtB.生成108 g银,转移的电子为1 mol
C.Cu+在负极发生氧化反应D.Cl-由正极迁移到负极
【答案】A
【解析】
由电池的总反应可知Ag+得电子生成Ag单质,银电极上得电子,发生还原反应,为原电池的正极,Cu+失去电子生成Cu2+,在Pt电极上发生氧化反应,为原电池的负极,据此判断。
A.原电池中电子由负极经导线移向正极,即电子的运动方向:Pt→导线→Ag,电子不能在溶液中移动,A项错误;
B. 正极上的电极反应为:Ag++e-= Ag,108g(即1mol)银生成时电子转移为1mol,B项正确;
C. 负极上Cu+失去电子生成Cu2+,发生氧化反应,C项正确;
D. 电解质溶液中阴离子向负极移动,故Cl-由正极迁移到负极,D正确;
答案选A。

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目