题目内容
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。据图判断正确的是 ( )
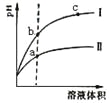
A.Ⅱ为盐酸稀释时pH变化曲线
B.a点Kw的数值比c点Kw的数值大
C.b点溶液的导电性比c点溶液的导电性强
D.b点酸的总浓度大于a点酸的总浓度
【答案】C
【解析】
A.CH3COOH是弱酸,在水溶液中部分电离,HCl是强电解质,在水溶液中完全电离,pH相同的醋酸和盐酸,c(CH3COOH)>c(HCl),加水稀释促进醋酸电离,pH相同的醋酸和盐酸稀释相同的倍数,pH变化大的是HCl、变化小的是醋酸,根据图知,Ⅱ是醋酸、l是盐酸,故A错误;
B.离子积常数只与温度有关,与溶液酸性强弱无关,a、c两点溶液温度相同,其离子积常数相同,故B错误;
C.溶液导电性与离子浓度成正比,根据图知,c点pH大于b点,所以b点氢离子浓度大于c点,b点溶液导电能力大于c点,故C正确;
D. II是醋酸、I是盐酸,pH相同的醋酸和盐酸,c(CH3COOH)>c(HCl),加水稀释相同的倍数,醋酸浓度仍然大于盐酸,所以b点酸的总浓度小于a点酸的总浓度,故D错误;
答案选C。

 智慧小复习系列答案
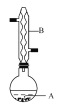
智慧小复习系列答案【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
![]() +
+![]()
![]()
![]() +H2O
+H2O
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.812 3 | 131 | 微溶 |
乙酸 | 60 | 1.049 2 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.867 0 | 142 | 难溶 |
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50 min,反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液 和水 洗涤,分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
(1)仪器B的名称是________,它的作用是____________________。
(2)在洗涤操作中,第一次水洗的主要目是___________________________
第二次水洗的主要目的是_______________________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后____(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是_____________________________。
(5)实验中加入少量无水MgSO4的目的是___________________________。
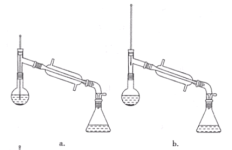
(6)在蒸馏操作中,仪器选择及安装都正确的是____(填标号)。
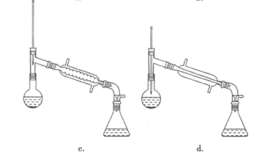
(7)本实验的产率是____(填标号)。
a.30% b.40% c. 60% d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏____(填“高”或“低”),其原因是____________________________________。
【题目】下列说法正确的是( )
A.电离平衡常数可以表示弱电解质的相对强弱
B.电离平衡常数受溶液浓度的影响
C.H2CO3的电离常数表达式:K=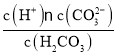
D.电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大
【题目】工业上以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体,其工艺流程如下:

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO![]() 形式存在且易被氧化。
形式存在且易被氧化。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.1 | — | — |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 4.7(>10溶解) | 5.6(>9溶解) |
(1)提高酸浸速率的措施有__________________________________(答两条)。
(2)滤渣1的主要成分是_____;滤渣2的主要成分是_____;滤渣3的主要成分是_____。
(3)流程中两次使用了H2O2进行氧化,H2O2的电子式为___________;第一次氧化时反应的离子方程式为_____________________;第二次氧化时目的是____________________。
(4)流程图中“ ”内的操作是________________、洗涤、干燥。
(5)除去酸性废水中含有的Cr2O72-可以使用FeSO4,测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。该反应的离子方程式为_________________________________。