题目内容
20.有一瓶无色气体可能含有H2S,CO2,HBr,SO2,Cl2中的一种或几种.将其通入稀氯水中得到无色透明溶液.将溶液分成两份,向一份中加入用稀HNO3酸化的AgNO3溶液,生成白色沉淀;向另一份中用稀盐酸酸化的BaCl2溶液,也生成白色沉淀.①则原气体中肯定含有SO2,可能含有CO2
②对可能含有的成份,请你设计一套简单合理的实验方案,检验其有无,并具体说明在此方案中,气体通过各试剂的作用(用文字表示所用试剂先后顺序,用→表示气体流向)
气体-→过量的酸性KMnO4溶液→品红溶液→澄清石灰水
各试剂作用用酸性KMnO4溶液除去SO2,用品红试液验证SO2是否除尽,用澄清石灰水验证CO2是否存在.
分析 ①由无色气体可排除Cl2;通入Cl2水得到无色透明溶液,可知肯定无H2S、HBr;向一份中加入用稀HNO3酸化的AgNO3溶液,生成白色沉淀,该白色沉淀可能为硫酸银或氯化银;向另一份中用稀盐酸酸化的BaCl2溶液,也生成白色沉淀,则一定存在SO2;无法确定是否含有CO2;
②检验二氧化硫中是否含有二氧化碳,首先应该除去二氧化硫,然后用澄清石灰水检验,据此进行分析.
解答 解:①由无色气体可排除Cl2;通入Cl2水得到无色透明溶液,可知肯定无H2S、HBr;向一份中加入用稀HNO3酸化的AgNO3溶液,生成白色沉淀,该白色沉淀可能为硫酸银或氯化银;向另一份中用稀盐酸酸化的BaCl2溶液,也生成白色沉淀,则一定存在SO2;无法确定是否含有CO2,
根据分析可知,混合气体中一定含有的气体为:SO2,不能确定的为CO2,一定不存在的气体为:H2S、HBr、Cl2,
故答案为:SO2;CO2;
②检验是否有CO2时必须排除SO2的干扰,所以用KMnO4除去SO2,用品红试液验证SO2是否被除尽,用澄清石灰水验证CO2是否存在,所以气体通过的各试剂的顺序为:气体→过量的酸性KMnO4溶液→品红溶液→澄清石灰水,用酸性KMnO4溶液除去二氧化硫,用品红试液验证SO2是否除尽,用澄清石灰水验证CO2是否存在,
故答案为:过量的酸性KMnO4溶液→品红溶液→澄清石灰水,用酸性KMnO4溶液除去SO2,用品红试液验证SO2是否除尽,用澄清石灰水验证CO2是否存在.
点评 本题考查了未知物的检验,题目难度中等,明确常见气体的性质及检验方法为解答关键,②中检验二氧化碳的是否存在为易错点,需要排除二氧化硫的干扰,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
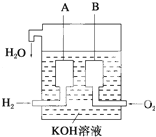
10.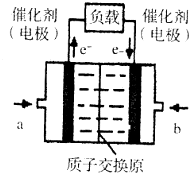 氢氧燃料电池已用于航天飞机.以硫酸溶液为电解质溶液,电子经外电路、质子(H+)经内电路到达另一电极后发生电极反应,这种电池(如图)在使用时的电极反应如下:
氢氧燃料电池已用于航天飞机.以硫酸溶液为电解质溶液,电子经外电路、质子(H+)经内电路到达另一电极后发生电极反应,这种电池(如图)在使用时的电极反应如下:
2H2-4e-═4H+
O2+4e-+4H+═2H2O
下列说法不正确的是( )
 氢氧燃料电池已用于航天飞机.以硫酸溶液为电解质溶液,电子经外电路、质子(H+)经内电路到达另一电极后发生电极反应,这种电池(如图)在使用时的电极反应如下:
氢氧燃料电池已用于航天飞机.以硫酸溶液为电解质溶液,电子经外电路、质子(H+)经内电路到达另一电极后发生电极反应,这种电池(如图)在使用时的电极反应如下:2H2-4e-═4H+
O2+4e-+4H+═2H2O
下列说法不正确的是( )
| A. | 右电极为电池正极,b处通入的物质是氧气 | |
| B. | 左电极为电池负极,a处通入的物质是氧气 | |
| C. | H2在负极发生氧化反应 | |
| D. | 供电时的总反应为:2H2+O2=2H2O |
11.下列物质的分子中既有σ键,又有π键的是( )
| A. | H2O | B. | N2 | C. | H2O2 | D. | C2H4 |
8.能用浓硫酸干燥的一组气体是( )
| A. | H2和NH3 | B. | H2,SO2和CO | C. | H2S和SO2 | D. | NH3,H2S和SO2 |
15.要除CO2气中含有的HCl(g),H2O(g),SO2杂质,应使气体依次通过( )
| A. | Na2CO3溶液,浓H2SO4,品红溶液 | B. | 品红溶液,Na2CO3溶液,浓H2SO4 | ||
| C. | 小苏打溶液,无水氯化钙 | D. | 酸性KMnO4溶液,碱石灰 |
12.不可以证明可逆反应N2+3H2?2NH3已达到平衡状态的是( )
| A. | 一个N≡N断裂的同时,有3个H-H键断裂 | |
| B. | 保持其它条件不变时,体系压强不再改变 | |
| C. | 恒温恒容时,密度保持不变 | |
| D. | 正反应速率v(H2)=0.6mol/L•min,逆反应速率v(NH3)=0.4mol/L•min |
10.下列装置或操作能达到实验目的是( )
| A. | 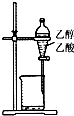 除去乙醇中的乙酸 | B. | 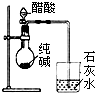 证明醋酸是弱酸 | ||
| C. | 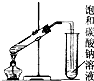 制取乙酸乙酯 | D. | 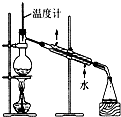 石油的分馏 |
 (1)分子式为C8H10,含有苯环的同分异构体有4种;其中苯环上的一个氢原子被氯原子取代后产生同分异构体数目最少的是
(1)分子式为C8H10,含有苯环的同分异构体有4种;其中苯环上的一个氢原子被氯原子取代后产生同分异构体数目最少的是 ; (填结构简式)
; (填结构简式)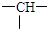 ,它可能的结构数目是( )
,它可能的结构数目是( )