题目内容
已知2Zn(s)+O2(g)=2ZnO(s)ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g) 2HgO(s)ΔH=-181.6 kJ·mol-1
2HgO(s)ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为( )
2Hg(l)+O2(g)
 2HgO(s)ΔH=-181.6 kJ·mol-1
2HgO(s)ΔH=-181.6 kJ·mol-1则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为( )
| A.+519.4 kJ·mol-1 | B.+259.7 kJ·mol-1 |
| C.-259.7 kJ·mol-1 | D.-519.4 kJ·mol-1 |
C
由盖斯定律,第一个式子减去第二个式子除以2得:
Zn(s)+HgO(s)=ZnO(s)+Hg(l)
ΔH=(-701.0 kJ·mol-1+181.6 kJ·mol-1)/2
=-259.7 kJ·mol-1。
Zn(s)+HgO(s)=ZnO(s)+Hg(l)
ΔH=(-701.0 kJ·mol-1+181.6 kJ·mol-1)/2
=-259.7 kJ·mol-1。

练习册系列答案
相关题目

 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:

 CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
CO(g)+2H2(g),H2的物质的量随时间变化的曲线如图所示。
 CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。
CH3OH(g)的平衡常数K=__________。相同温度下,若开始时加入CH3OH(g)的物质的量是原来的2倍,则__________(填序号)是原来的2倍。 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol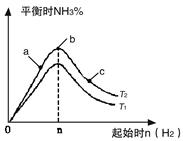
 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据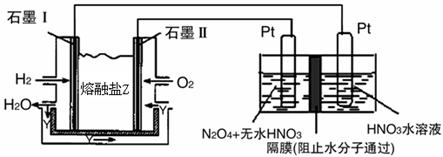
 2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率( )与体系总压强(P)、温度(T)的关系如图所示。回答下列问题:
)与体系总压强(P)、温度(T)的关系如图所示。回答下列问题:
 2SO3(g) ΔH="-Q" kJ·mol-1。向一密闭容器中加入2 mol SO2和1 mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1 kJ;向另一相同容器中加入2 mol SO3,在相同条件下,达平衡时吸收的热量为Q2 kJ,则下列关系中正确的是( )
2SO3(g) ΔH="-Q" kJ·mol-1。向一密闭容器中加入2 mol SO2和1 mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1 kJ;向另一相同容器中加入2 mol SO3,在相同条件下,达平衡时吸收的热量为Q2 kJ,则下列关系中正确的是( )