题目内容
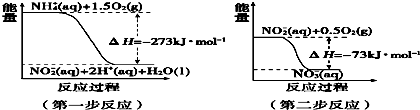
7.写出下列反应的热化学方程式.(1)在1.01×105Pa时,4g氢气在O2中完全燃烧生成液态水,放出572KJ的热量,则H2的燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286KJ/mol.
(2)3molNO2气体溶于水生成HNO3和NO气体,放出138kJ热量3NO2(g)+H2O(l)═2HNO3(aq)+NO(g)△H=-138kJ/mol.
(3)实验测得25℃、101kPa时1molC完全燃烧放出393.5kJ的热量,写出C燃烧的热化学方程式:C(s)+$\frac{1}{2}$O2(g)=CO2(g)△H=-393.5kJ/mol.
(4)实验测得25℃、101kPa时1molH2完全燃烧放出285.8 kJ的热量,写出H2燃烧的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ/mol.
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;根据n=$\frac{m}{M}$计算1mol氢气完全燃烧放出的热量,结合热化学方程式的书写方法写出热化学方程式;
(2)3mol NO2气体与水完全反应生成硝酸溶液和NO气体,放出热量138kJ,结合热化学方程式的书写方法写出热化学方程式;
(3)实验测得25℃、101kPa时1molC完全燃烧放出393.5kJ的热量,标注物质聚集状态和对应焓变写出热化学方程式;
(4)实验测得25℃、101kPa时1molH2完全燃烧放出285.8 kJ的热量,生成水为液体,标注物质聚集状态和对应焓变写出热化学方程式.
解答 解:(1)4g氢气的物质的量为:n=$\frac{m}{M}$=$\frac{4g}{2g/mol}$=2mol,2molH2在O2中完全燃烧生成2.00mol液态H2O放出572kJ的热量,所以1mol氢气完全燃烧放出热量286KJ,氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286KJ/mol;H2的燃烧热为286KJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286KJ/mol;
(2)3mol气体参加反应放出138kJ热量,则热化学方程式为3NO2(g)+H2O(l)═2HNO3(aq)+NO(g)△H=-138kJ/mol,
故答案为:3NO2(g)+H2O(l)═2HNO3(aq)+NO(g)△H=-138kJ/mol;
(3)实验测得25℃、101kPa时1molC完全燃烧放出393.5kJ的热量,热化学方程式为:C(s)+$\frac{1}{2}$O2(g)=CO2(g)△H=-393.5kJ/mol,
故答案为:C(s)+$\frac{1}{2}$O2(g)=CO2(g)△H=-393.5kJ/mol;
(4)实验测得25℃、101kPa时1molH2完全燃烧放出285.8 kJ的热量,生成水为液体,写出热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ/mol.
点评 本题考查了热化学方程式的书写原则和方法应用,燃烧热概念的分析判断,热化学方程式的计算应用,题目较简单.

 百年学典课时学练测系列答案
百年学典课时学练测系列答案| A. | 生成物的物质的量分数增大 | B. | v正>v逆 | ||
| C. | 反应物浓度降低 | D. | 反应物的体积分数减少 |
| A. | 2:3 | B. | 1:1 | C. | 3:4 | D. | 24:27 |
①pH=0的硫酸和水等体积混合后的溶液;②等体积等浓度的NaOH溶液和盐酸的混合液;③0.1mol•L-1的氨水和0.1mol•L-1的盐酸等体积混合后的溶液;④pH=3的盐酸和pH=12的NaOH溶液等体积混合后的溶液.
| A. | ①>②>③>④ | B. | ②>①>④>③ | C. | ③>④>②>① | D. | ③>②>④>① |
已知:反应I:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应II:2NO(g)+O2(g)?2NO2(g)△H2 (且|△H1|=2|△H2|)
反应III:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
反应I和反应II在不同温度时的平衡常数及其大小关系如表
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
①计算0~4分钟在A催化剂作用下,反应速率v(NO)=0.375mol•L-1•min-1.
②下列说法不正确的是CD.
A.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
C.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
D.增大压强能使反应速率加快,是因为增加了活化分子百分数
(3)一定条件下,反应II达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2.恒温恒压时,在其它条件不变时,再充入NO2气体,NO2体积分数不变(填“变大”、“变小”或“不变”)
(4)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图2,溶液中OH-向电极a移动(填a或b),负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.

| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反映的中和热△H=2×(-57.3)kJ/mol | |
| B. | 已知2C(s)+2O2(g)═2CO2(g)△H1,2C(s)+O2(g)═2CO(g)△H2则△H1<△H2 | |
| C. | 在101 kPa,25℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ的热量;氢 气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l);△H=-285.8kJ/mol | |
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |