题目内容
12.(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应,已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,则2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+l530kJ/mol;
(2)在微生物作用的条件下,NH${\;}_{4}^{+}$经过两步反应被氧化成NO${\;}_{3}^{-}$.两步反应的能量变化示意图如下:
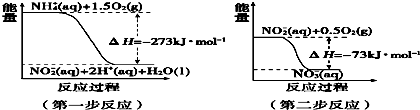
①第一步反应是放热反应(填“放热”或“吸热”),判断依据是反应物能量高于生成物.
②1 mol NH${\;}_{4}^{+}$(aq)全部氧化成NO${\;}_{3}^{-}$(aq)的热化学方程式是NH4+(aq)+2O2(g)=2H+(aq)+H2O(l)+NO3-(aq)△H=-346kJ/mol.
分析 (1)已知①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1;
以上两热化学方程式消去氢气合并,①×2+②×3得到热化学方程式为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530kJ/mol;
(2)①图象分析可知,第一步反应反应物能量高于生成物,反应为放热反应;
②1mol NH4+(aq)全部氧化成NO3-(aq)可由两步反应加和得到,热化学方程式为NH4+(aq)+2O2(g)=2H+(aq)+H2O(l)+NO3-(aq)△H=-346kJ/mol.
解答 解:(1)已知①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1;
以上两热化学方程式消去氢气合并,①×2+②×3得到热化学方程式为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530kJ/mol,
故答案为:+l530kJ/mol;
(2)①图象分析可知,第一步反应反应物能量高于生成物,依据能量守恒分析可知反应为放热反应,
故答案为:放热,反应物能量高于生成物;
②1mol NH4+(aq)全部氧化成NO3-(aq)可由两步反应加和得到,热化学方程式为NH4+(aq)+2O2(g)=2H+(aq)+H2O(l)+NO3-(aq)△H=-346kJ/mol,
故答案为:NH4+(aq)+2O2(g)=2H+(aq)+H2O(l)+NO3-(aq)△H=-346kJ/mol.
点评 本题盖斯定律的应用,题目难度不大,注意热化学方程式的处理,掌握基础是解题关键,注意图象分析判断.

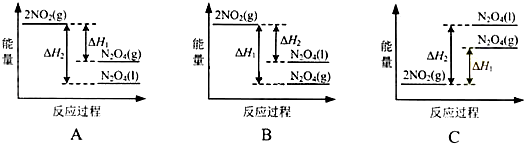
| A. | Q1=2Q2=Q | B. | Ql>2Q2 | C. | Q1<2Q2 | D. | Q1=2Q2≠Q |
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
(1)该反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,△H<0(填“<”、“>”或“=”)
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=0.006 mol•L-1•min-1,CO的平衡转化率为60%.
(3)1000℃时,在(2)的平衡体系中,各加0.5molCO和0.5molCO2,v正>v逆(填“<”、“>”或“=”),平衡向正向移动(填“正向”、“逆向”或“不移动”).
| A. | 常温常压下,5.6 L一氧化碳和5.6 L氧气混合后的分子总数为0.5NA | |
| B. | 标准状况下,5.6 L N2和16.8L NO混合气体中的原子数为2NA | |
| C. | 标准状况下,22.4L H2O中分子数为NA | |
| D. | 常温常压下,1 mol氦气含有的原子数为2NA |
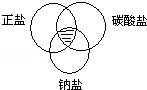 符合图中阴影部分的物质是( )
符合图中阴影部分的物质是( )| A. | Na2CO3 | B. | BaSO4 | C. | MgCl2 | D. | NaHCO3 |