题目内容
6.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: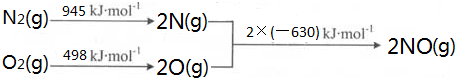
①写出该反应的热化学方程式N2(g)+O2(g)=2NO(g)△H=+183kJ/mol.
②随温度升高,该反应化学平衡常数的变化趋势是增大.(填“增大”、“减小”或“不变”)
分析 ①根据能量变化图计算反应热,反应热=反应物的键能和-生成物的键能和,从而书写热化学方程式;
②化学平衡常数和温度有关,升高温度,平衡向着吸热方向进行,降低温度向着放热方向进行.
解答 解:该反应中的反应热=反应物的键能和-生成物的键能和=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,所以N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+183kJ•mol-1;升高温度,平衡向着吸热方向进行,K增大,
故答案为:N2(g)+O2(g)=2NO(g)△H=+183kJ/mol;增大.
点评 本题考查了反应热量变化的计算,反应热=反应物的键能和-生成物的键能和,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
16.意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子,下列说法正确的是( )
| A. | N4属于一种新型的化合物 | |
| B. | 等质量的N4与N2所含的原子个数比为2:1 | |
| C. | N4与N2的摩尔质量相等 | |
| D. | 等质量的N4与N2所含的原子个数比为1:1 |
17.用饱和的氯化铁溶液制取氢氧化铁胶体,正确的操作是( )
| A. | 将饱和FeCl3溶液滴入蒸馏水即可 | |
| B. | 将饱和FeCl3溶液滴入热水中,生成棕黄色液体即可 | |
| C. | 将饱和FeCl3溶液滴入沸水中,并继续煮沸至溶液呈红褐色即可 | |
| D. | 将饱和FeCl3溶液滴入沸水中,并继续煮沸至出现红褐色沉淀即可 |
14.可逆反应A(g)+3B(g)2C(g)+D(g),在不同条件下的反应速率如下,其中反应速率最快的是( )
| A. | v(A)=0.5 mol/(L•min) | B. | v(B)=0.02mol/(L•s) | ||
| C. | v(C)=0.8 mol/(L•min) | D. | v(D)=0.01mol/(L•s) |
18.原子序数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,核内质子数为2n2-1.下列有关X的说法中不正确的是( )
| A. | X原子的最外层电子数和核电荷数肯定为奇数 | |
| B. | X可能形成化学式为KXO3的含氧酸钾盐 | |
| C. | X能形成化学式为X(OH)3的碱 | |
| D. | X能与某些金属元素形成离子化合物 |
15.下列物质中所含原子的物质的量最多的是( )
| A. | 4g 氦气 | B. | 1.25mol O2 | ||
| C. | 22.4升 Cl2(标准状况) | D. | 6.02×1023个SO2分子 |